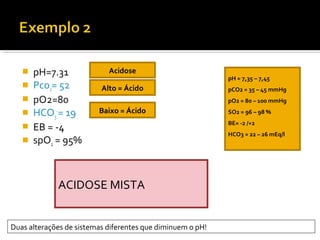
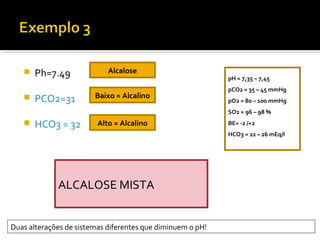
O documento discute os seguintes tópicos:
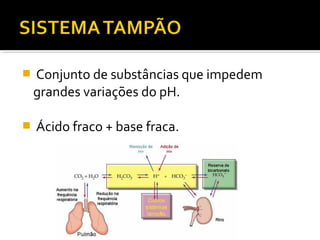
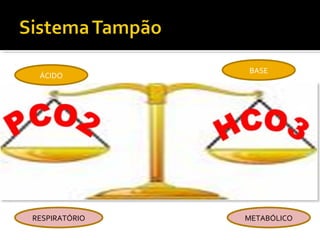
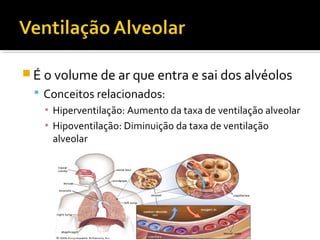
1) Regulação do equilíbrio ácido-básico no organismo, incluindo tampões, sistemas respiratório, renal e metabólico;
2) Conceitos como pH, potencial hidrogeniônico, ácidos e bases;
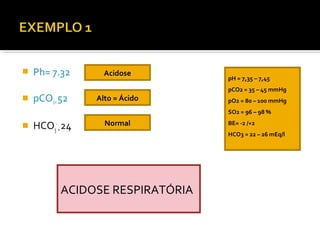
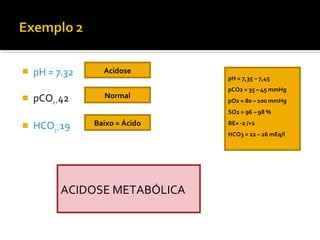
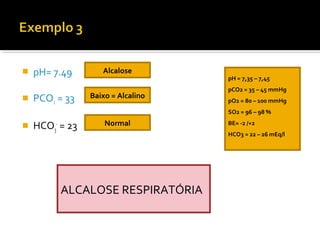
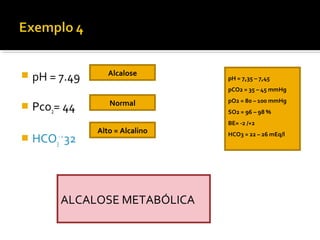
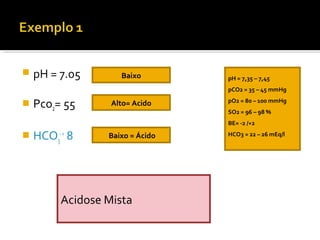
3) Parâmetros da gasometria arterial e suas interpretações no diagnóstico de distúrbios ácido-básicos.