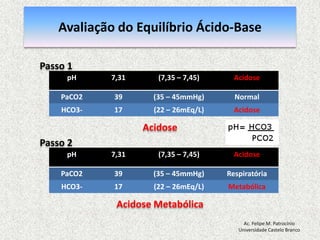
O documento apresenta os fundamentos do equilíbrio ácido-base (EAB) e da interpretação da gasometria arterial. Discute os princípios básicos do EAB, a sistematização da interpretação da gasometria arterial e os componentes do EAB como pH, PaCO2 e HCO3-. Também aborda as alterações ácido-base como acidose e alcalose respiratória e metabólica, a avaliação e compensação do EAB.























![↑[H+] ↓pH Ácido](https://image.slidesharecdn.com/equilibrio2-110921050316-phpapp01/85/Introducao-a-Gasometria-Arterial-25-320.jpg)
![↓[H+] ↑pH BaseAc. Felipe M. PatrocínioUniversidade Castelo Branco](https://image.slidesharecdn.com/equilibrio2-110921050316-phpapp01/85/Introducao-a-Gasometria-Arterial-26-320.jpg)
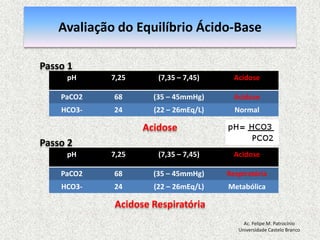
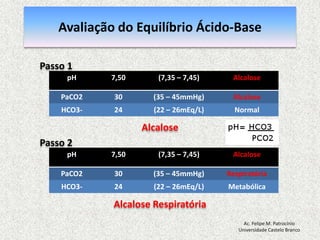
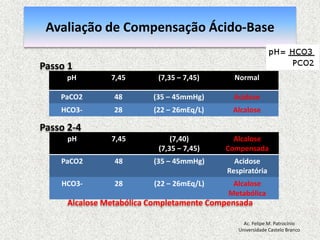
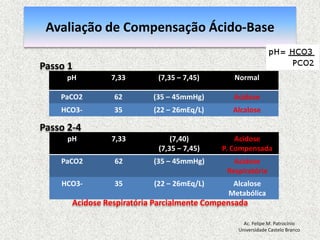
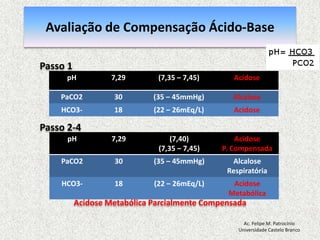
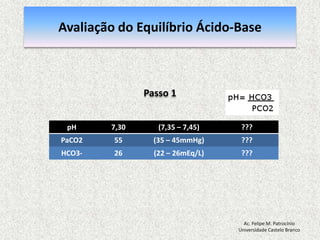
![Equilíbrio Ácido-basepH = 7,40: [H+] = 40 nmol/L pH = - log [H+] = 7,40 pH < 7,35: acidemia (Acidose) pH > 7,45: alcalemia (Alcalose) pH < 6,80 o pH > 7,80: incompatívelcom a vidaAc. Felipe M. PatrocínioUniversidade Castelo Branco](https://image.slidesharecdn.com/equilibrio2-110921050316-phpapp01/85/Introducao-a-Gasometria-Arterial-27-320.jpg)
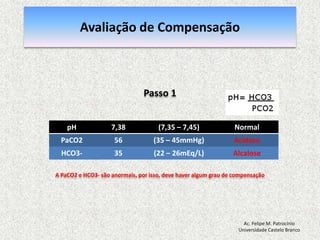
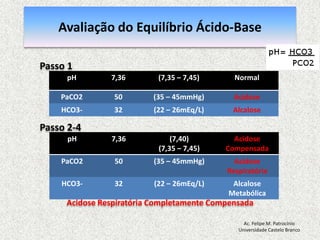
![Equilibrio Ácido-base RegulaçãoEquacãode Henderson-Hasselbalch [H+] = 24 x (PCO2 / [HCO3-]) pH = [HCO3-] / PCO2pH = Rim (metabólico) / Pulmão (respiratorio)Ac. Felipe M. PatrocínioUniversidade Castelo Branco](https://image.slidesharecdn.com/equilibrio2-110921050316-phpapp01/85/Introducao-a-Gasometria-Arterial-29-320.jpg)