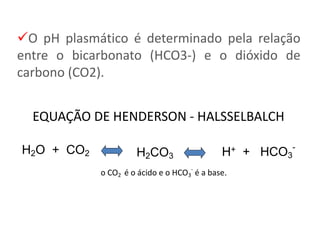
O documento discute distúrbios do equilíbrio ácido-básico no sangue, incluindo como medir com uma gasometria. Existem três sistemas que ajudam a manter o pH sanguíneo: tampões plasmáticos, sistema pulmonar e sistema renal. A fórmula de Henderson-Hasselbalch descreve a relação entre o dióxido de carbono e o bicarbonato no sangue que determina o pH.



![H +
Sua regulação é essencial, pois a atividade
de quase todos os sistemas de enzimas do
corpo são influenciados por sua [ ].](https://image.slidesharecdn.com/gasometria-181006151546/85/Gasometria-4-320.jpg)
![ÁCIDO:
Toda molécula que, quando adicionada à solução
aquosa, libera íons hidrogênio [H+]
HCL H+ + CL- (Cloreto)
BASE:
Toda substância que, quando adicionada à solução
aquosa, consome íons (H+) ou libera íons OH-
NH4 (amônio) NH3 + H+
HCO3
-
+ H+ H2CO3
Um H + é um próton único, livre, liberado
do átomo de Hidrogênio.](https://image.slidesharecdn.com/gasometria-181006151546/85/Gasometria-5-320.jpg)
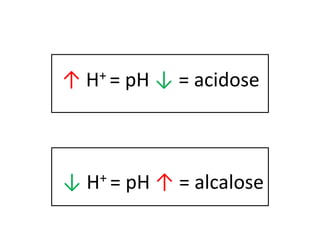
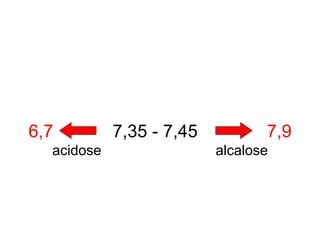
![As alterações no pH são inversamente
relacionadas às alterações na [ ] de H+
A maneira mais fácil de medir a [ ] do H+ no
sangue é através do pH.
pH H+
pH = - log [ H+ ]](https://image.slidesharecdn.com/gasometria-181006151546/85/Gasometria-6-320.jpg)



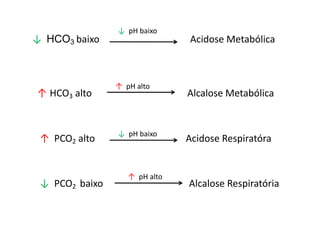

![Distúrbio ácido-básico
Fórmula de compensação
Ac. Met. – diminui o HCO3 e reduz PCO2 ↓ PCO2= 1,5 x [HCO3] + 8
Al. Met. – aumenta HCO3 e aumenta PCO2 ↑ 7mmHg de PCO2 para cada 10mEq/L de
HCO3
Ac. Resp. Aguda – aumenta PCO2 e aumenta HCO3 ↑ 1mmHg de HCO3 para cada 10mmHg de
PCO2
Ac. Resp. crônica - aumenta PCO2 e aumento da HCO3 ↑ 3,5 mmHg de HCO3 para cada 10
mmHg de PCO2
Al. Resp. Aguda - diminui PCO2 e diminui HCO3 ↓ 2 mEq/l de HCO3 para cada 10 mmHg
de PCO2
Al. Resp. Crônica– diminui PCO2 e diminui HCO3 ↓ 4 mEq/l de HCO3 para cada 10 mmHg de
PCO2](https://image.slidesharecdn.com/gasometria-181006151546/85/Gasometria-16-320.jpg)
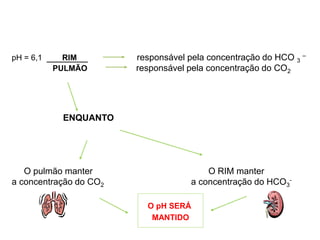
![Dr. Paulo N. Rocha Nefrologia – MED111
GASÔMETRIA - Passos
1. Determine se existe acidemia ou alcalemia (olhar o pH)
2. Determine se o distúrbio primário é respiratório ou metabólico
Distúrbio respiratório é quando a alteração primária é do CO2 e Distúrbio metabólico
é quando a alteração primária é do Bicarbonato.
1. Se o distúrbio primário for respiratório, determine se é agudo ou
crônico (olhar o BE – base excess)
2. Se o distúrbio primário for metabólico, determine se a resposta
respiratória é adequada (fazer os cálculos de compensação)
3. Determine se o ânion gap está normal ou alargado
O Cálculo é feito: [Na – (CL + HCO3)], até 12 está normal.
1. Existe distúrbio misto? Ex: Alcalose Metabólica e Alcalose Respiratória.
2. Existe distúrbio compensatório?](https://image.slidesharecdn.com/gasometria-181006151546/85/Gasometria-17-320.jpg)