O documento discute os conceitos fundamentais de equilíbrio ácido-base, incluindo:
1) A importância do íon hidrogênio e do pH no corpo;
2) A definição de ácidos e bases segundo as teorias de Arrhenius e Brönsted-Lowry;
3) Os sistemas tampão mais importantes no corpo, especialmente o sistema ácido carbônico-bicarbonato.



![Íon hidrogênioO H+ - íon mais importante nos sistemas biológicos[H+] – influencia- a velocidade das reações químicas. - a forma e função das enzimas e de proteínas celulares e a integridade das células[H+] - 0,4nM(0,4x10-7)](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-4-320.jpg)


![Dissociação da água e seus produtos iônicosH2O + H2O OH -+H3O+A água funciona tanto como ácido quanto como base[H3O+] [OH -][H3O+] [OH -] Lei da ação das massas:K ==[H2O] [H2O][H2O]2= 10-14Na água pura a [H+] é igual a [OH-] que é igual a 10-7](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-7-320.jpg)
![Potencial hidrogeniônico (pH) A [H+] de uma solução é quantificada em unidades de pH](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-8-320.jpg)
![pH = -log [H+]](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-9-320.jpg)
![A escala de pH varia de 1 até 14.pH x homeostasia Homeostasia é a constância do meio interno equilíbrio entre a entrada ou produção de íons hidrogênio e a livre remoção desses íons do organismo. o organismo dispõe de mecanismos para manter a [H+] e, conseqüentemente o pH sangüineo, dentro da normalidade, ou seja manter a homeostasia .pH do Sangue ArterialpH normalAcidoseAlcalose7,87,47,0Faixa de sobrevida](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-10-320.jpg)
![Alterações no pHAcúmulo de ácidosPerda de basesAumento da [H+]AcidoseQueda do pH7,4Escala de pHAlcaloseAumento do pHDiminuição da [H+]Perda de ácidosAcúmulo de bases](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-11-320.jpg)


![Medidas de pHpHmetroEletrométricoPotenciômetro mede [H+]diferença de potencial elétricoentre duas soluçõesindicadoresColorimétricoIndicadorIndicador-H H++(Cor A)(Cor B)](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-14-320.jpg)







![Eficiência de um tampãoQuanto maior o número de moles que é necessário adicionar a um meio contendo um sistema tampão, de modo a alterar significativamente a concentração de H+, mais eficiente é o tampão.Pela equação de Handerson-Hasselbalch, pH = pKa + log ([A-]/[HA]) O pH depende das concentrações do ácido (HA) e da base (A-).](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-22-320.jpg)
![O sistema tampão será mais eficiente quando [A-]=[HA], ou seja, quando o pH = pKa.](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-23-320.jpg)




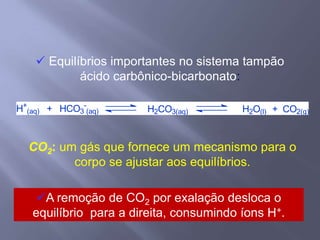

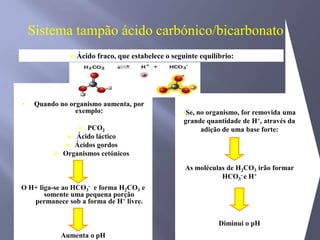

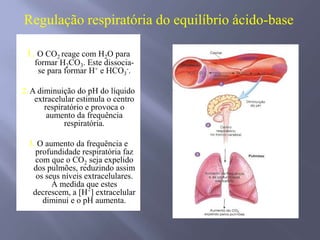
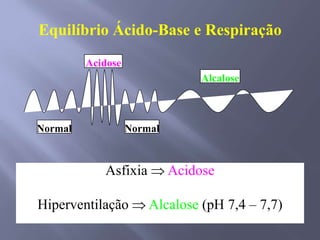



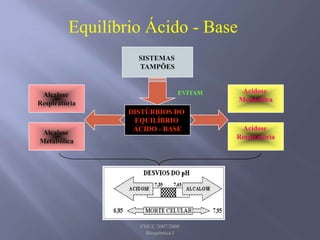



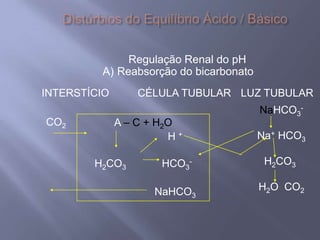
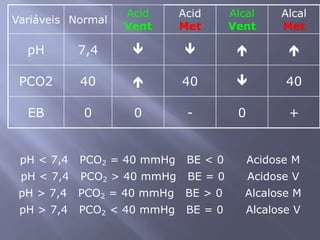
![SANGUE COMO UMA SOLUÇÃO-TAMPÃO Os principais órgãos que regulam o pH do sistema tampão ácido carbônico-bicarbonato são pulmões e rins. Receptores no cérebro - sensíveis às concentrações de H+ e CO2 nos fluídos corpóreos. Quando a concentração de CO2 aumenta, os equilíbrios deslocam-se para a esquerda, o que leva à formação de mais H+. Os receptores disparam um reflexo para respirar mais rápido e mais profundamente, aumentando a velocidade de eliminação de CO2 dos pulmões e deslocando o equilíbrio de volta para a direita. Os rins absorvem ou liberam H+ e HCO3-; muito do excesso de ácido deixa o corpo na urina, que normalmente tem pH de 5,0 a 7,0.Regulação respiratória do equilíbrio ácido-base1. O CO2 reage com H2O para formar H2CO3. Este dissocia-se para formar H+ e HCO3-. 2. A diminuição do pH do líquido extracelular estimula o centro respiratório e provoca o aumento da frequência respiratória.3. O aumento da frequência e profundidade respiratória faz com que o CO2 seja expelido dos pulmões, reduzindo assim os seus níveis extracelulares. À medida que estes decrescem, a [H+] extracelular diminui e o pH aumenta.](https://image.slidesharecdn.com/aulaequilbriocidobase-110528114016-phpapp02/85/Aula-equilibrio-acido-base-42-320.jpg)