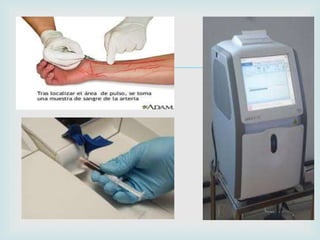
O documento aborda a gasometria, um procedimento que mede a concentração de íons hidrogênio, pressão de oxigênio e dióxido de carbono no sangue, avaliando a oxigenação e a ventilação. Define os tipos de gasometria, destaca a importância dos índices de oxigenação e explora a regulação do equilíbrio ácido-base, abordando acidose e alcalose. Além disso, descreve a avaliação da gasometria e os mecanismos de compensação que mantém o pH dentro dos limites normais.









![Regulação do
desequilíbrio
Equação de Henderson – Hasselbach
[H+] = 24 x (PCO2 / [HCO3-])
pH = [HCO3-] / PCO2
pH = rim (metabólico) / pulmão (respiratório)](https://image.slidesharecdn.com/auladegasometria-141019135759-conversion-gate01/85/Aula-de-gasometria-11-320.jpg)









![Avaliação do pH
pH = 7,40: [H+] = 40 nmol/L
pH= - log [H+] = 7,40
pH < 7,35 : acidemia ( acidose)
pH > 7,45 : alcalemia (alcalose)
pH < 6,80 ou pH > 7,80: incompatível com a vida](https://image.slidesharecdn.com/auladegasometria-141019135759-conversion-gate01/85/Aula-de-gasometria-21-320.jpg)

















