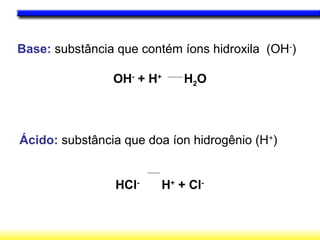
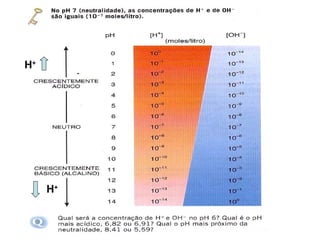
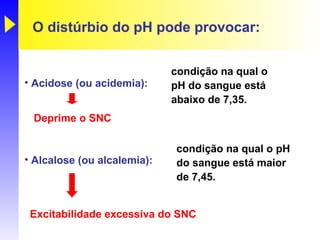
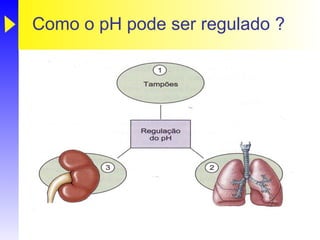
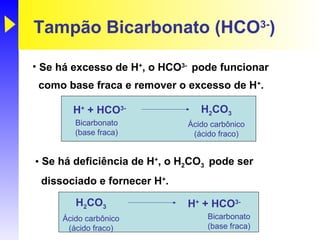
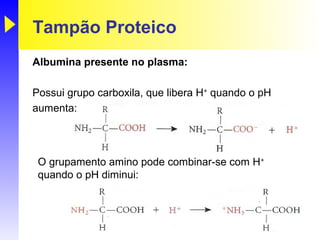
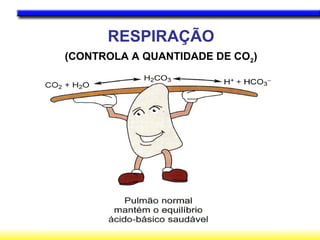
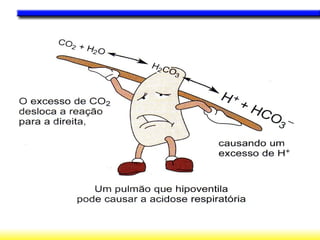
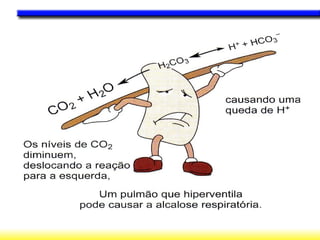
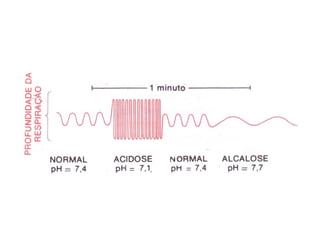
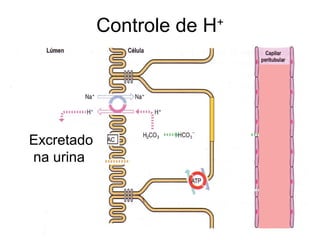
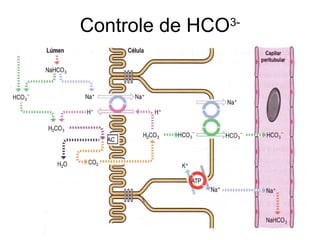
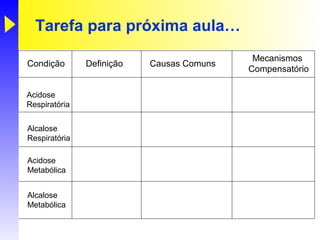
O documento discute o equilíbrio ácido-base no corpo, incluindo: 1) O pH indica a quantidade de íons hidrogênio na solução; 2) Os tampões como o bicarbonato ajudam a regular o pH absorvendo ou liberando íons hidrogênio; 3) A respiração controla a quantidade de dióxido de carbono, que afeta o pH.