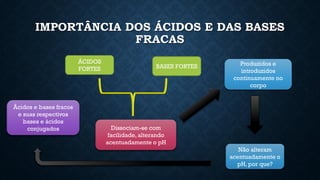
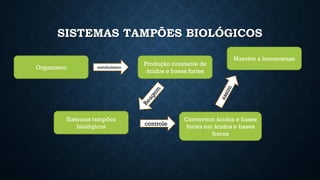
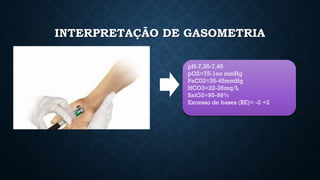
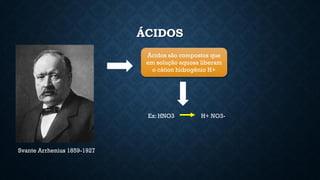
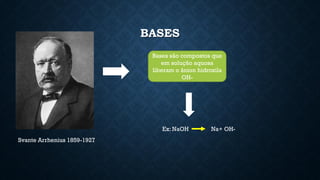
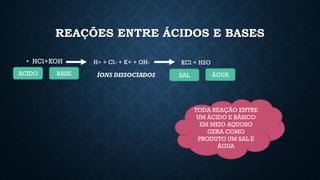
O documento aborda conceitos fundamentais de química, como o potencial hidrogênio (pH), o potencial hidroxiliônico (pOH) e sistemas tampão em soluções aquosas. Explica a definição, classificação e reações entre ácidos e bases, além de discutir a importância desses compostos na homeostase do organismo. Também ressalta a relevância de sistemas tampões biológicos e apresenta exemplos e padrões de pH de diferentes substâncias, bem como as consequências de desequilíbrios acidobásicos.






![CÁLCULO PARA CHEGAR NESTA ESCALA
• Kw= ([H+].[OH-]= 10 -14, onde Kw = constante de dissociação da água, [H+]=
concentração de íons H+ na solução e [OH-] concentração de íons OH- na solução
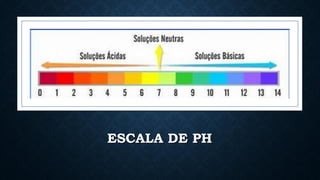
Numa escala de pH, o número 7 indica a neutralidade, poucas
substâncias são neutras, as que teoricamente se apresentam como
neutras são levemente alcalinas ou levemente ácidas.
pH+pOH=14](https://image.slidesharecdn.com/aula03cidosbasesphetampo-240531125653-a8445f2a/85/AULA-03-ACIDOS-E-BASES-PH-E-EFEITO-TAMPAO-12-320.jpg)