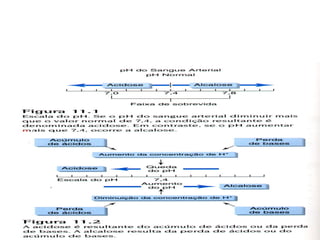
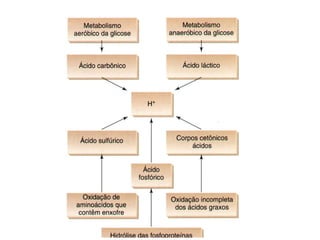
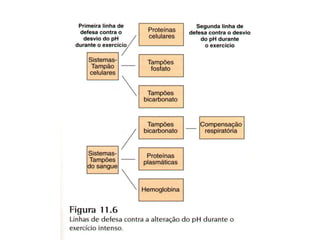
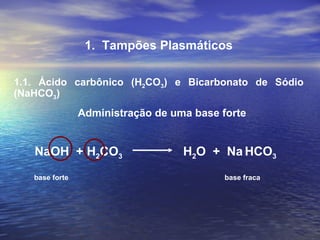
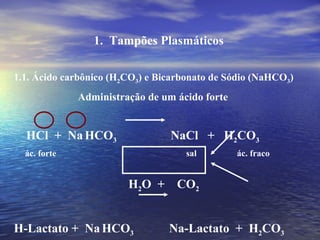
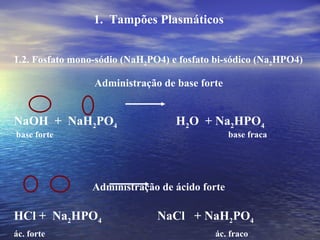
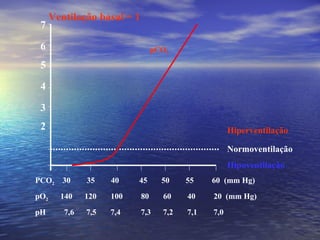
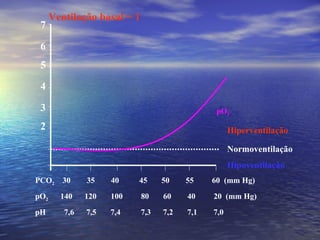
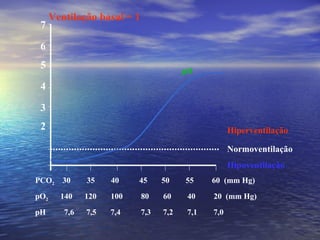
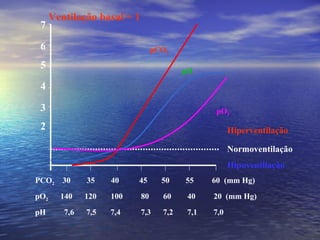
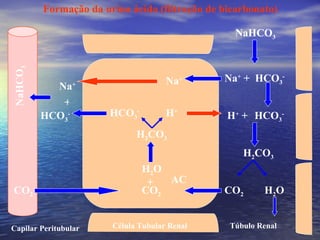
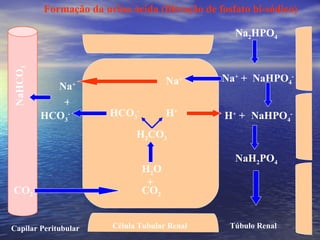
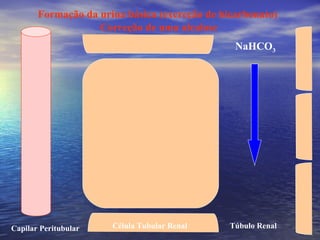
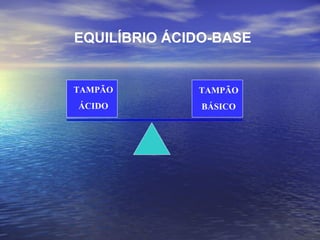
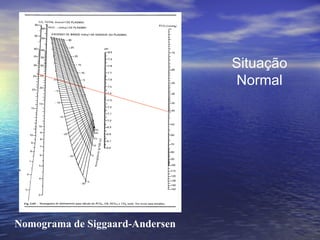
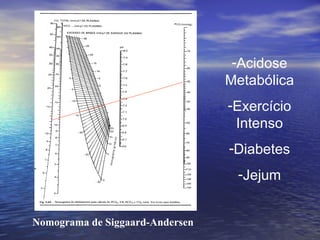
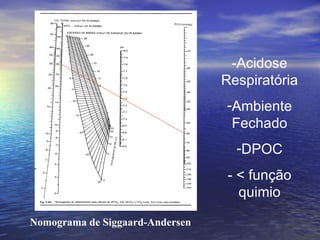
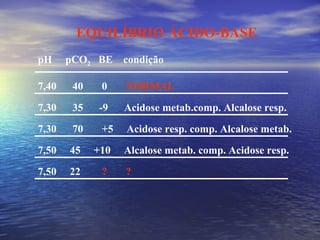
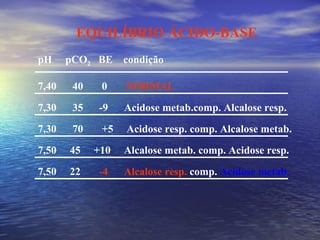
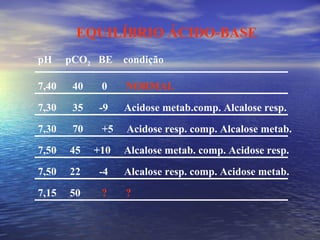
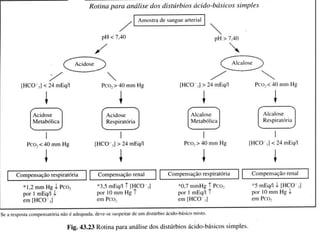
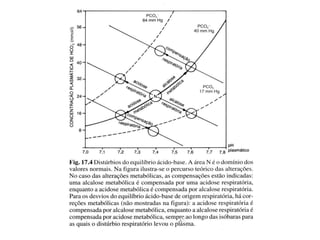
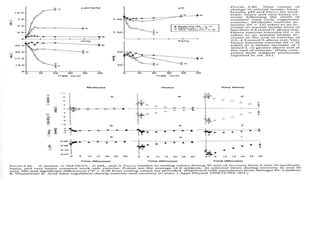
O documento discute o equilíbrio ácido-básico no corpo, incluindo: 1) definições de ácido, base e pH; 2) importância clínica e no exercício; 3) equação de Henderson-Hasselbach para calcular pH; e 4) mecanismos de manutenção do pH, incluindo tampões, sistema respiratório e renal.
![Equilíbrio Ácido Básico Prof. Cristiano Lino M Barros [email_address]](https://image.slidesharecdn.com/equilibrioacidobasico-100605071804-phpapp01/75/Equilibrio-acido-basico-1-2048.jpg)




![Como calcular o pH de uma solução [H+ ] = 1,5 x 10 2- pH = -log[H+ ] pH = -log 1,5 x 10 2- pH = -log 1,5 – log 10 2- pH = 0,1761 – (-2) pH = 1,82 [H+ ] = 1,9 x 10 6- pH = -log[H+ ] pH = -log 1,9 x 10 6- pH = -log 1,9 – log 10 6- pH = 0,2787 – (-6) pH = 5,72 pH = -log[H+ ] pH = -log 3,7 x 10 8- pH = -log 1,5 – log 10 8- pH = 0,5682 – (-8) pH = 7,43](https://image.slidesharecdn.com/equilibrioacidobasico-100605071804-phpapp01/85/Equilibrio-acido-basico-6-320.jpg)
![Como calcular a [H+] de uma solução pH = -log [H+] = 4,222 pH = log [H+] = -4,222 [H+] = antilog (-4,222) [H+] = antilog (5-4,222) x antilog 10 -5 [H+] = antilog (0,778) x 10 -5 [H+] = 6 x 10 -5](https://image.slidesharecdn.com/equilibrioacidobasico-100605071804-phpapp01/85/Equilibrio-acido-basico-7-320.jpg)
![Como calcular a [H+] de uma solução pH = -log [H+] = 8,8 pH = log [H+] = -8,8 [H+] = antilog (-8,8) [H+] = antilog (9-8,8) x antilog 10 -9 [H+] = antilog (0,2) x 10 -9 [H+] = 1,59 x 10 -9](https://image.slidesharecdn.com/equilibrioacidobasico-100605071804-phpapp01/85/Equilibrio-acido-basico-8-320.jpg)




![Equação de Henderson-Hasselbach K1 = [H][HCO 3 ] [H 2 CO 3 ] K2 = [CO 2 ] [H 2 CO 3 ] K = K1 / K2](https://image.slidesharecdn.com/equilibrioacidobasico-100605071804-phpapp01/85/Equilibrio-acido-basico-13-320.jpg)
![Equação de Henderson-Hasselbach K = [H][HCO 3 ] [CO 2 ] H = K [CO 2 ] [HCO 3 ] x log](https://image.slidesharecdn.com/equilibrioacidobasico-100605071804-phpapp01/85/Equilibrio-acido-basico-14-320.jpg)