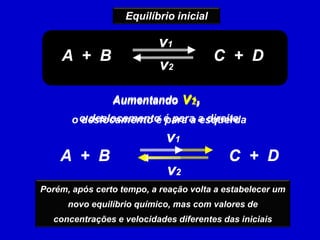
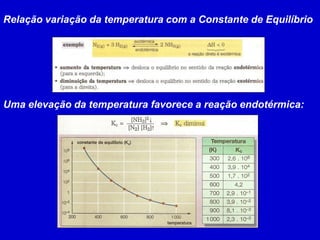
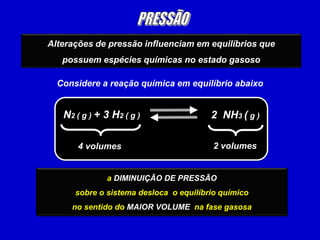
Este documento discute o princípio de Le Chatelier e como diferentes fatores afetam o equilíbrio químico. Ele explica que quando um sistema em equilíbrio é perturbado, o equilíbrio se desloca no sentido de minimizar a perturbação. Fatores como temperatura, concentração de reagentes e pressão podem causar esse deslocamento de equilíbrio.