Incorporar apresentação
Baixado 115 vezes




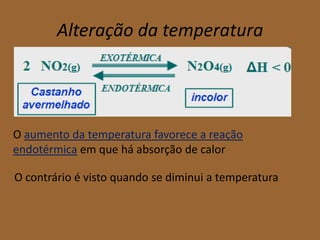


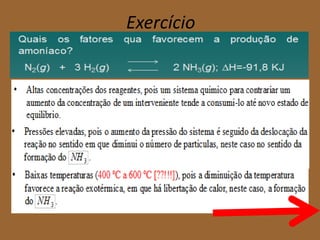

O Princípio de Le Châtelier estabelece que quando um sistema químico em equilíbrio é perturbado por uma mudança de concentração, pressão ou temperatura, o sistema se deslocará no sentido de contrariar a perturbação e restabelecer um novo equilíbrio. Alterações de concentração são contrariadas pelo consumo do componente cuja concentração aumentou. Alterações de pressão são contrariadas por reações que diminuam o número de moles. E alterações de temperatura são contrariadas por reações endotérmicas ou








