Este documento discute equilíbrio químico, incluindo:
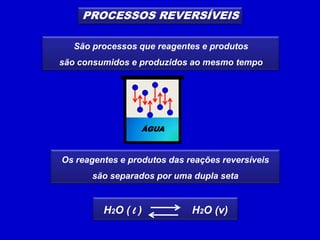
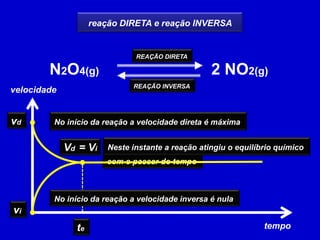
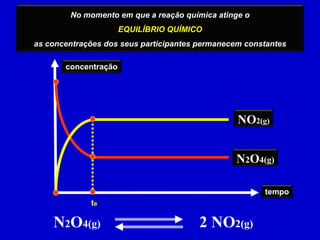
1) Reações reversíveis atingem o equilíbrio quando as velocidades das reações direta e inversa são iguais.
2) A constante de equilíbrio depende da concentração das substâncias no equilíbrio e é independente das concentrações iniciais.
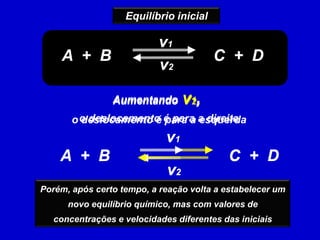
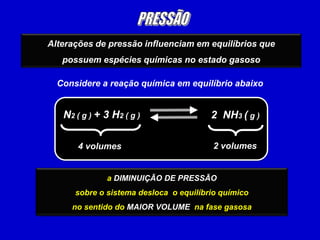
3) O equilíbrio químico pode ser deslocado alterando fatores como temperatura, concentração e pressão.


![CONSTANTE DE EQUILÍBRIO EM TERMOS DE CONCENTRAÇÃO MOLARVamos considerar uma reação reversível genérica 1a A + b Bc C + d D2No equilíbrio teremos:acbdK1 [ A ] [ B ]K2 [ C ] [ D ]V 1=V 2cdK1[ C ] [ D ]=KCIsolando-se as constantesab[ A ] [ B ]K2](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-6-320.jpg)

![2 H2( g ) + O2( g )N2( g ) + 3 H2( g )2 NH3( g )2 H2O( g )22[ O2 ][ H2 ][ NH3 ]KCKC==32[ H2O ][ N2 ][ H2 ]](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-8-320.jpg)

![02) (Covest – 98) Medidas de concentração para o sistema abaixo, em equilíbrio, a uma certa temperatura forneceram os seguintes resultados:[ H2 ] = 0,10 mol/LH2( g ) + I2( g )2 HI ( g )[ I2 ] = 0,20 mol/L[ HI ] = 1,0 mol/LDetermine a constante de equilíbrio da reação nestas condições.2[ HI ]( 1,0 )1,0 KC = 50KC==[ H2 ][ I2 ](0,20)(0,10)0,02x](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-10-320.jpg)
![03) Temos representado no gráfico abaixo as concentrações dos reagentes e dos produtos de uma mesma reação do tipo:A + BC + DOcorrendo no sentido à direita a partir do zero. 10[ ]864caminho da reação2Tem-se sempre [A] = [B] e [C] = [D], estando estes valores representados no gráfico. A constante de equilíbrio da reação será igual a: 16. 1/4. 4. 5. 1/16.[ C ]8[ D ]864xKC=[ A ]44[ B ]16xKC = 4](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-11-320.jpg)
![04) Foram colocados em um recipiente fechado, de capacidade 2,0 L, 6,5 mol de CO e 5 mol de NO2. À 200°C o equilíbrio foi atingido e verificou-se que haviam sido formados 3,5 mol de CO2. Podemos dizer que o valor de Kc para o equilíbrio dessa reação é:a) 4,23.b) 3,84.c) 2,72.d) 1,96.e) 3,72.CO + NO2CO2 + NOinício6,5 5,0 0,0 0,0 reage / produz3,5 3,5 3,5 3,5 equilíbrio3,5 3,5 3,0 1,5 3,5 [ NO ] [ CO2 ] = 1,75 M [ CO2 ] = x= KC2,0 [ CO ] [ NO2 ] x3,5 = 1,75 M [ NO ] = 1,751,752,0 x= KC3,0 1,500,75x= 1,50 M [ CO ] = 2,0 3,0625KCKC = 2,72= 1,5 1,125= 0,75 M [ NO2 ] = 2,0](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-12-320.jpg)
![05) Em um recipiente de 400 mL são colocados 2 mols de PCl5 gasoso a uma determinada temperatura. Esse gás se decompõem segundo a reação química abaixo, e, o equilíbrio foi alcançado quando 20% do pentacloreto de fósforo reagiram ( % em mols ). A constante de equilíbrio, Kc, nessas condições, vale:a) 4,0.b) 1,0.c) 0,5.d) 0,25.e) 0,025.PCl5PCl3 + Cl2início2,0 0,0 0,0 reage / produz0,4 0,4 0,4 equilíbrio1,60,4 0,4 0,41,0 x 1,0[ PCl3 ] [ Cl2 ] [ PCl3 ] = 1,0 M= xKC= = 0,4 [ PCl5 ] 4,00,4= 1,0 M[ Cl2 ] = 1,00,4 KC= 4,01,6= 4,0 M[ PCl5 ] = 0,4 KC = 0,25Reage : n = 0,2 x 2 = 0,4 mol](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-13-320.jpg)











![Constante de IonizaçãoPara a reação:+–+HCNHCN(aq)(aq)(aq)–+[ H ] [ CN ] Ki= [ HCN ]](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-28-320.jpg)

![–02) (FUVEST-SP) A reaçãoH3C – COOH H+ + H3C – COOtem – 5Ka = 1,8 x 10Dada amostra de vinagre foi diluída com água até se obter uma soluçãode [H+] = 1,0 x 10 mol/L – 3–Nesta solução as concentrações em mol/L de CH3COO e de CH3COOH são, respectivamente, da ordem de:– 3+[ H ] = 1,0 x 10 – 1– 10 3 x 10 e 5 x 10 .– 1– 2b) 3 x 10 e 5 x 10 .– 3–[ CH3COO ] =1,0 x 10 – 3– 5c) 1 x 10 e 5 x 10 .+–– 3– 12d) 1 x 10 e 5 x 10 .[ H ] [ CH3COO ]= Ki– 3– 2e) 1 x 10 e 5 x 10 .[ CH3COOH ]– 3– 31,0 x 10 1,0 x 10 – 5x1,8 x 10=[ CH3COOH ]– 3– 31,0 x 10 1,0 x 10 x– 2[ CH3COOH ]==5,0 x 10– 51,8 x 10](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-30-320.jpg)

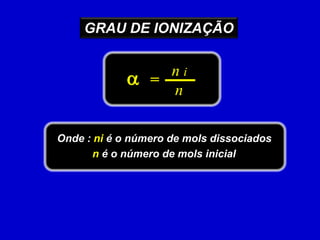
![DEMONSTRAÇÃO DA FÓRMULA–+HAHPara a reação:+A(aq)(aq)(aq)início0,0 0,0 naaannnni=reage / produzaaannn–nequilíbrioaaannn ( 1 – )[ ] VVVaannx+–aaV[ H ] [ A ] nnVVx= = xKi=a[ HCN ] aVVn ( 1 – )n ( 1 – )V2ma2mapara solução de graude ionização pequenoKiKi= = a1 –](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-32-320.jpg)





![Medidas experimentais de condutibilidade de corrente elétricamostram que a água, pura ou quando usada como solvente, se ioniza fracamente, formando o equilíbrio iônico:+–H2OOHH+(aq)( l )(aq)–+[ H ] [ OH ] A constante de equilíbrio será:Ki =[ H2O ] como a concentração da água é praticamente constante, teremos:–+[ H ] [ OH ] = Ki x [ Kc] Kw–– 14– 14+A 25°C a constante “Kw” vale 10 mol/L[ H ] [ OH ] = 10PRODUTO IÔNICO DA ÁGUA ( Kw )](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-38-320.jpg)
![Um alvejante de roupas, do tipo “ água de lavadeira “, apresenta [OH ] aproximadamente igual a 1,0 x 10 mol/L. Nessas condições, a concentração de H será da ordem de:–– 4+ –– 4– 2a) 10b) 10c) 10d) 10 e) zero.= 10 M[ OH ] – 3+[H ] = ? – 10– 14Kw = 10 M – 14– 14+–– 4[H ] = [OH ] 10 10x– 1410 +[H ] = – 410– 10+[H ] = 10 mol/L](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-39-320.jpg)
![02) Qual das expressões abaixo é conhecida como “produto iônico da água, KW”? Kw = [H2][O2]. Kw = [H+] / [OH – ]. Kw = [H+][OH – ]. Kw = [H2O]. Kw = [2H][O2].](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-40-320.jpg)
![Em água pura a concentração hidrogeniônica [H ] é igual à concentração hidroxiliônica [OH ], isto é, a 25°C, observa-se que:+––+= = – 7[H ] 10 [OH ] Nestas condições dizemos que a solução é “ NEUTRA “](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-41-320.jpg)
![As soluções em que [H ] > [OH ] terão características ÁCIDAS–+nestas soluções teremos+– 7[ H ] >10 mol/L–– 7[OH ] 10 mol/L<](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-42-320.jpg)
![As soluções em que [H ] < [OH ] terão características BÁSICAS–+nestas soluções teremos+[ H ] – 7<10 mol/L–[OH ] – 710 mol/L>](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-43-320.jpg)


![03) Misturando-se 100 mL de suco de laranja, cuja [H +] = 0,6 mol/L, com 200 mL de suco de laranja, cuja [H +] = 0,3 mol/L, não se obtém: uma solução onde [H +] = 0,4 mol/L. uma solução completamente neutra. uma solução de acidez intermediária. uma solução menos ácida do que a de [H +] = 0,6 mol/L. uma solução mais ácida do que a de [H +] = 0,3 mol/L.V1 = 100 mLV2 = 200 mLVf = 300 mL+++[H ]1 = 0,6 mol/L[H ]2 = 0,3 mol/L[H ]f = ? mol/LVf x [H ]f = V1x [H ]1 + V2x [H ]2++++300 x [H ]f = 100 x 0,6 + 200 x 0,3+300 x [H ]f = 60 + 60++[H ]f = 120 : 300[H ]f = 0,4 mol/L](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-46-320.jpg)
![04) Observando a tabela abaixo, podemos afirmar que entre os líquidos citados tem(êm) caráter ácido apenas: –+[ OH ] [ H ] Líquido– 7– 71010Leite– 8– 61010Água do mar– 3– 111010Coca-cola– 5– 91010Café preparado– 710– 710Lágrima– 12– 21010Água de lavadeiraa) O leite e a lágrima.b) A água de lavadeira.c) O café preparado e a coca-cola.d) A água do mar e a água de lavadeira.e) A coca-cola.](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-47-320.jpg)
![Como os valores das concentrações hidrogeniônica e oxidriliônica são pequenos,é comum representá-las na forma de logaritmos e, surgiram os conceitos depH e pOH +=– log [ H ]pH–=pOH– log [ OH ]](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-48-320.jpg)


![01) A concentração dos íons H de uma solução é igual a 0,0001. O pH desta solução é:+a) 1.b) 2.c) 4.d) 10.e) 14.+– 40,0001 mol/L10 mol/L[ H ] =+=– log [ H ]pH– 4– log 10pH=pH = – ( – 4) x log 10pH = 4 x 1pH = 4](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-51-320.jpg)
![02) A concentração hidrogeniônica de uma solução é de 3,45 x 10 íons – g/L. O pH desta solução vale:– 11Dado: log 3,45 = 0,54a) 11.b) 3.c) 3,54.d) 5,4.e) 10,46.+– 11[ H ] = 3,45 x 10 +pH = – log [H ]– 11pH = – log (3,45 x 10 )– 11pH = – [log 3,45 + log 10 ]pH = – [ 0,54 – 11 ]pH = 11 – 0,54pH = 10,46](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-52-320.jpg)
![03) Considere os sistemas numerados (25°C)pH = 3,0Vinagre1pH = 6,8Leite2pH = 8,0Clara de ovos34pH = 8,5Sal de frutaspH = 6,0Saliva5A respeito desses sistemas, NÃO podemos afirmar:a) São de caráter básico os sistemas 3 e 4.b) O de maior acidez é o número 1. O de número 5 é mais ácido que o de número 2. O de número 1 é duas vezes mais ácido que o de número 5.e) O de menor acidez é o sal de frutas.o 1 é 1000 vezesmais ácido do que 5, então é FALSO– 3– 3+1 tem pH = 3[ H ] 1010=3= 10– 6– 6+105 tem pH = 6[ H ] 10=](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-53-320.jpg)
![04) (UPE-2004 - Q1) Na tabela, há alguns sistemas aquosos com os respectivos valores aproximados de pH, a 25°C.pH = 3,0vinagresalivapH = 8,0limpa - fornopH = 13,0pH = 9,0água do marsuco gástricopH = 1,0Considerando os sistemas aquosos da tabela, é correto afirmar que: O vinagre é três vezes mais ácido que o suco gástrico.+ – 3 +[ H ] = 10 Mb) No vinagre, a concentração de íons H3O é cem mil vezes maior que a da saliva.pH = 3,0vinagre– 2 = 10 A água do mar é menos alcalina que a saliva e mais ácida que o vinagre.+ – 1 + – 3 pH = 1,0suco gástrico[ H ] = 10 MpH = 3,0vinagre[ H ] = 10 M5 = 10 O sistema aquoso limpa - forno é o que contém o menor número de mols de oxidrila por litro.é 100 vezes menor + – 8 [ H ] = 10 MpH = 8,0salivaO suco gástrico constitui um sistema aquoso fracamente ácido.é 100000 vezes maior](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-54-320.jpg)









![03) (UFPE) O azul de bromotimol é um indicador ácido – base, com faixa de viragem [6,0 – 7,6], que apresenta cor amarela em meio ácido e cor azul em meio básico. Considere os seguintes sistemas: Água pura. CH3COOH 1,0 mol/L. III. NH4Cl 1,0 mol/L.Indique, na tabela que segue, a coluna contendo as cores desses sistemasdepois da adição de azul de bromotimol, respectivamente: verde, amarela, azul. verde, azul, verde. verde, amarelo, verde. verde, amarela, amarelo. azul, amarelo, azul.](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-71-320.jpg)

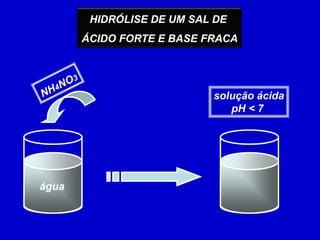
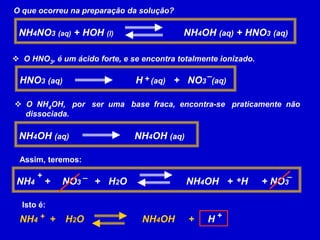
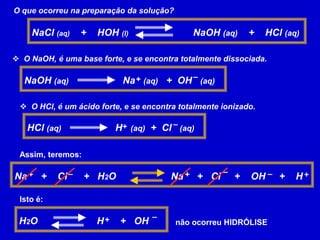
![CONSTANTE DE HIDRÓLISEÉ a expressão que exprime o equilíbrio das reações de hidrólise.NH4 +H2O NH4OH + HPara a reação++A expressão da constante de hidrólise é:+[ NH4OH ][ H ]Kh=+[ NH4 ]](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-73-320.jpg)

![01) (UFPI) Uma solução aquosa de cloreto de amônio 0,2 mol/L apresenta um grau de hidrólise igual a 0,5%. Determine o [H+], [OH –], pH, pOH e Kh para essa solução e o Kb para o NH4OH.Dado: Kw = 10 – 14, a 25°C.O NH4Cl é proveniente do HCl (ácido forte) e do NH4OH (base fraca), então ocorre a hidrólise do cátion NH4+, então: NH4 +H2O NH4OH + H++0,0inícioconstante 0,00,2reage e produz– 3– 3– 3101010equilíbrioconstante– 3– 30,2 mol/L1010Kw– 14– 3– 11–10+[H ] = 10 mol/L [OH ] = 10 mol/L – 3Kh = – 65 x 10 = Reage e produz:0,2 x 0,005 = 0,001 = 10– 3KbpH = - log 10pH = 3 e pOH = 11 – 9+[NH4OH]Kb = 2 x 10[H ]– 3– 31010– 6XKh = = 5 x 10 +– 1[NH4 ]2 x 10](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-75-320.jpg)
![PRODUTO DE SOLUBILIDADEVamos considerar um sistema contendo uma solução saturada com corpo de fundo de sulfeto ferroso (FeS). Teremos dois processos ocorrendo:2 –2+FeS (s) Fe (aq) + S (aq)No equilíbrio a velocidade de dissolução (vd) é igual à velocidade de precipitação (vp).2+2–[ Fe ] [S ]2–2+Então teremos que:= [ Fe ] [S ]Kc x [FeS] Kc =KS[FeS]vdvpConhecendo-se a solubilidade do sal, podemos determinar o Kps. KSproduto desolubilidade](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-76-320.jpg)
![01) (Fuvest – SP) Em determinada temperatura, a solubilidade do sulfato de prata (Ag2SO4) em água é de 2,0 x 10 – 2 mol/L. Qual o valor do produto de solubilidade (Kps ) desse sal, à mesma temperatura? +–2Ag2SO42 Ag+ SO4–2–2–22 x 10 mol/L2 x 10 mol/L4 x 10 mol/L–22+KS = [ Ag ] [SO4 ]–22–2KS = (4 x 10 ) x 2 x 10–4–2KS = 16 x 10 x 2 x 10–6KS = 32 x 10–5KS = 3,2 x 10](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-77-320.jpg)
![02) O carbonato de bário, BaCO3, tem Ks = 1,6 x 10 – 9, sob 25°C. A solubilidade desse sal, em mol/L, será igual a: 4 x 10 – 5. 16 x 10 – 5. 8 x 10 – 10. 4 x 10 – 10. 32 x 10 – 20.+2–2BaCO3Ba+ CO3SSS–2Ks+2[CO3 ]=[Ba ]1,6 x 10 – 9SSx–92S = 1,6 x 10–10S = 16 x 10–5S = 4 x 10](https://image.slidesharecdn.com/equilbrioqumico-110816131626-phpapp01/85/Equilibrio-Quimico-78-320.jpg)


