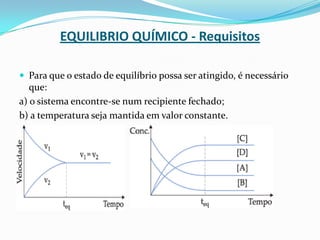
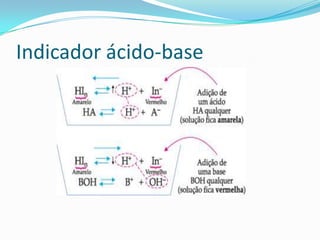
O documento discute conceitos de equilíbrio químico, incluindo: 1) o conceito de equilíbrio químico e os requisitos para seu estabelecimento; 2) a classificação de equilíbrios químicos em homogêneos e heterogêneos; 3) os fatores que podem deslocar o equilíbrio químico, como concentração, pressão e temperatura.




![EQUILIBRIO QUÍMICO - Concentração (Kc)
aA + bB cC + dD
Aplicando-se a lei da ação das massas de Guldberg-Waage, temos:
para a reação direta: v1 = K1 · [A]a · [B]b
para a reação inversa: v2 = K2 · [C]c · [D]d
No equilíbrio: v1 = v2 ou seja:
Igualando as equações: K1 · [A]a · [B]b = K2 · [C]c · [D]d
A relação é constante e denomina-se constante de equilíbrio em
termos de concentração molar (Kc):
A constante de equilíbrio Kc é, portanto, a razão das concentrações dos
produtos da reação e das concentrações dos reagentes da reação, todas
elevadas a expoentes que correspondem aos coeficientes da reação.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-6-320.jpg)
![EQUILIBRIO QUÍMICO - Concentração (Kc)
a) A constante de equilíbrio Kc varia com a temperatura;
b) Quanto maior o valor de Kc , maior o rendimento da
reação, já que no numerador temos as [ ] dos produtos e no
denominador, dos reagentes. Portanto, comparando valores
de Kc em duas temperaturas diferentes, podemos saber em
qual destas a reação direta apresenta maior rendimento;
c) O valor numérico de Kc depende de como é escrita a
equação química. Por exemplo:](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-7-320.jpg)

![EQUILIBRIO QUÍMICO – (Kp)
a) CaCO3 (s) CaO(s) + CO2 (g)
Kc = [CO2] Kp = (pCO2
)
b) Kp = pH2
c)
Kp não é definido, pois não há substância no estado gasoso, apenas
nos estados sólido e em solução aquosa.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-9-320.jpg)
















![Equilíbrio iônico da água
Podemos então concluir que a concentração de água ([H2O]) é
praticamente constante e, portanto,
O produto iônico da água, Kw, tem valor igual a 10–14 a 25 °C. Kw é
uma constante de equilíbrio e como tal não é afetada pela
variação na concentração de H+ ou OH–, mas varia com a
temperatura.
Soluções ácidas: [H+] > [OH-] ou [H+] > 10-7 e [OH-] < 10-7(mol/L),
Soluções básicas: [H+] < [OH-] ou [H+] < 10-7 e [OH-] > 10-7(mol/L),
Soluções neutras (ou água pura): [H+] = [OH-] = 10-7 mol/L.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-27-320.jpg)







![Relações entre Kh e Ka, Kb
Considerando a expressão da constante de
hidrólise dada anteriormente como exemplo:
Se multiplicarmos simultaneamente o numerador e o
denominador da fração por [H3O+] · [OH–], teremos:
Como:](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-35-320.jpg)


![Constante do produto de solubilidade (KPS)
Como todo equilíbrio, este também deve obedecer à lei:
Como a concentração de um sólido tem valor constante, o
produto Ki · [A2B3] da fórmula acima também é constante e é
chamado de produto de solubilidade: KPS = [A3+]2 . [B2-]3
Portanto, o produto de solubilidade (KPS ) é o produto das
concentrações molares dos íons existentes em uma solução
saturada, onde cada concentração é elevada a um expoente igual
ao respectivo coeficiente do íon na correspondente equação de
dissociação.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-38-320.jpg)

![Constante do produto de solubilidade (KPS)
Como apresentam a mesma proporção em íons (1 : 1), o CaCO3 é
mais solúvel que o BaCO3, porque possui maior valor de Kps.
Quando as substâncias comparadas possuem proporção em íons
diferentes, a mais solúvel é aquela que apresenta maior
solubilidade.
Exemplo:
Kps = [Ag+]2 · [CrO4
2-] 4·10 –12 = (2x)2 · x 4·10 –12 = 4x3
X = 1,0.10-4 mol/L
solubilidade do Ag2CrO4, portanto, em 1 L de solução é possível
dissolver até 10–4 mol de Ag2CrO4 = 0,033173 g.L-1ou 33,17 mg.L-1.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-40-320.jpg)
![Constante do produto de solubilidade (KPS)
BaSO4(s) Ba2+
(aq) + SO4
2-
(aq) KPS=1,0 . 10-10
Y mol/L Y mol/L Y mol/L
KPS=[Ba2+].[SO4
2-]
10-10=(Y).(Y) Y =
Y= 10-5 mol/L
Solubilidade do BaSO4 portanto, em 1 L de solução é possível
dissolver até 10–5 mol de BaSO4 = 0,23343 g.L-1 = 233,43 mg.L-1.
Com isso concluímos que Ag2CrO4 é cerca de 7 vezes mais
solúvel que o BaSO4.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-41-320.jpg)


![Previsão de Precipitação
Qps é denominado de quociente da reação, sendo calculado em
função da concentração de íons que são misturados. A
precipitação ocorre quando Qps é maior ou igual ao Kps. Em
nosso caso, encontramos:
Qps = [Pb2+] · [I–]2
Qps = (0,1) · (0,1)2
Qps = 1,0 · 10–3
Como Kps = 1,4 · 10–8 concluímos que Qps > Kps, portanto ocorre
precipitação.](https://image.slidesharecdn.com/ananery-oequilibrioqumico-130712155111-phpapp01/85/Ana-nery-o-equilibrio-quimico-44-320.jpg)