1) O documento discute equilíbrio químico e constante de equilíbrio, definindo a constante de equilíbrio como a relação entre as concentrações de produtos e reagentes no equilíbrio.
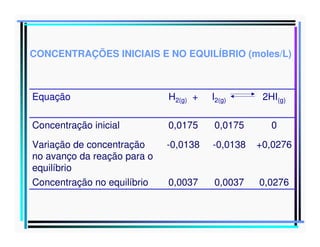
2) É apresentado um exemplo da reação entre H2, I2 e HI, calculando-se a constante de equilíbrio como sendo igual a 56.
3) São discutidos os efeitos da variação de temperatura, concentração inicial e volume no equilíbrio químico de acordo com o Pr


![CONSTANTE DE EQUILÍBRIO
H2(g)
+ I2(g)
2HI(g)
Um grande número de experiências mostra que, no
equilíbrio, a razão entre o quadrado da concentração
de HI e o produto das concentrações de H2 e I2.
[HI]2
[H2] [I2]](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-3-320.jpg)
![Substituindo esses valores das concentrações no
equilíbrio na expressão mencionada anteriormente:
[HI]2
[H2] [I2]
=
(0,0276)2
(0,0037) (0,0037)
= 56](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-5-320.jpg)
![CONSTANTE DE EQUILÍBRIO
Dada a equação simbólica:
aA
+
bB
cC
+
dD
As concentrações de reagentes e produtos no equilíbrio
são sempre relacionadas pela
EXPRESSÃO DA CONSTANTE DE EQUILÍBRIO
Concentração dos produtos
Constante de equilíbrio = K =
[C]c [D]d
[A]a [B]b
Concentração dos reagentes](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-6-320.jpg)


![Reações que Envolvem Sólidos e Água
1/8 S8(s)
+
O2(g)
K’ =
SO2(g)
[SO2]
[S8]1/8 [O2]
[SO2]
Como o enxofre é um sólido molecular, e como a
K =
concentração das moléculas ]
[O
2](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-9-320.jpg)
![Reações que Envolvem Sólidos e Água
NH3(aq) + H2O(l)
K =
NH4+(aq) + OH-(aq)
[NH4+] [OH-]
[NH3]](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-10-320.jpg)

![QUOCIENTE REACIONAL
Butano
Kc =
[Isobutano]
[Butano]
Isobutano
= 2,5 a 298 K
Se a concentração de um dos componentes for
conhecida, somente um certo valor da
concentração do outro composto obedecerá à
expressão da constante de equilíbrio.](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-13-320.jpg)
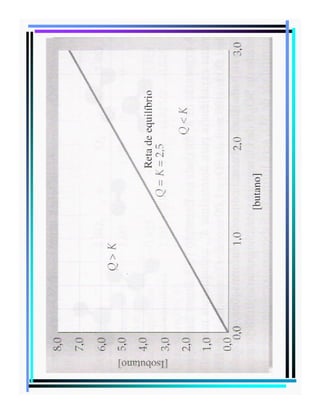
![QUOCIENTE REACIONAL
Qualquer ponto do plano da figura, sobre a
reta de equilíbrio ou fora desta, define uma
razão [isobutano]/[butano].
Essa razão recebe o nome de:
QUOCIENTE REACIONAL, Q
E é igual a constante de equilíbrio Kc quando
a reação está em equilíbrio.](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-15-320.jpg)
![QUOCIENTE REACIONAL
Qc =
[Isobutano]
[Butano]
=
4,0
3,0
= 1,3
O ponto representativo destas condições
está na região inferior da figura.
As concentrações não são concentrações de
equilíbrio, pois Qc < Kc.
Haverá transformação do butano em isobutano
para o equilíbrio para o equilíbrio ser atingido.](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-16-320.jpg)
![QUOCIENTE REACIONAL
Dada qualquer reação:
aA
+
bB
cC
+
dD
O quociente reacional, Q, se define pela equação
Quociente reacional = Q =
[C]c [D]d
[A]a [B]b](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-17-320.jpg)



![CÁLCULO DA CONSTATE DE EQUILÍBRIO
Exemplo 1:
Uma mistura de SO2, O2 e SO3 atinge o equilíbrio
a 852 K. As concentrações, neste equilíbrio, são
[SO2] = 3,61 x 10-3 mol / L, [O2] = 6,11 x 10-4 mol/L
e [SO3]= 1,01 x 10-2 mol/L. Calcular a constante
de equilíbrio Kc da reação.
2 SO2(g) + O2(g)
2SO3(g)](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-21-320.jpg)


![CÁLCULOS COM A CONSTATE DE
EQUILÍBRIO
Exemplo 2:
A reação
N2(g) + O2(g)
2NO(g)
Contribui para a poluição da atmosfera, sempre que se
queimam um combustível em presença de ar, a
temperatura elevada, como em um motor a gasolina. A
1.500 K, Kc = 1,0 x 10-5. Uma amostra de ar é aquecida a
1.500 K, num recipiente fechado. Antes da reação, [N2] =
0,80 mol/L e [O2] = 0,20 mol /L. Calcule a concentração
de NO no equilíbrio.](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-24-320.jpg)







![Exemplo:
Vamos trabalhar algebricamente o problema da
perturbação do equilíbrio entre o butano e o
isobutano. Imaginemos que há equilíbrio num balão
de 1,00 L no qual [butano] = 0,500 mol/L e
[isobutano] = 1,25 mol/L. Adiciona-se então, 1,50
mol/L de butano. Quais as novas concentrações do
butano e de isobutano em equilíbrio?](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-33-320.jpg)
![EFEITO DA MODIFICAÇÃO DE VOLUME
SOBRE O EQUILÍBRIO EM FASE
GASOSA
2 NO2(g)
N2O4(g)
Gás castanhoavermelhado
Gás incolor
Kc =
[N2O4]
[NO2]2
= 170 a 298 K
O que acontece a este equilíbrio se o volume do vaso
que contém os gases for bruscamente reduzido à
metade?](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-34-320.jpg)
![ A concentração do gás aumenta quando o volume
disponível diminui.
Há a duplicação do volume dos dois gases.
Isto significa que o sistema não está mais em equilíbrio.
No equilíbrio [N2O4] é 0,0280 mol/L e [NO2] é
0,0128 mol/L.
Quando dobrar: [N2O4] é 0,0560 mol/L e [NO2] é
0,0256 mol/L.
O quociente reacional nestas circunstâncias
passa a ser 85,5, um valor muito menor do que K.](https://image.slidesharecdn.com/equilibrio-131212161617-phpapp02/85/Equilibrio-quimico-35-320.jpg)

