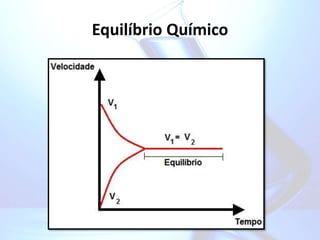
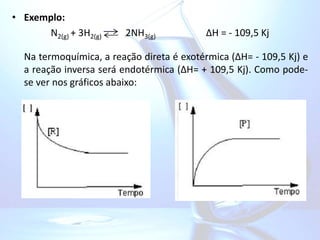
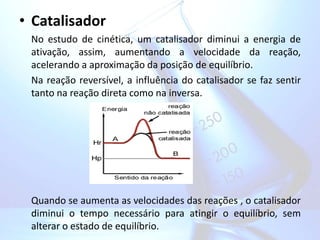
O documento discute reações químicas reversíveis e equilíbrio químico, incluindo fatores que influenciam no equilíbrio como concentração, pressão e temperatura. Também aborda constante de equilíbrio expressa em termos de concentração e pressão, além do princípio de Le Chatelier.




![Como calcular Kc?
aA + bB cC + dD
V1 = k1[A]a[B]b V2 = k2[C]c[D]d
k1[A]a[B]b = k2[C]c[D]d](https://image.slidesharecdn.com/02-230307151752-dcdabe9b/85/_02-ppt-6-320.jpg)
![Temos representado no gráfico abaixo as concentrações dos reagentes
e dos produtos de uma mesma reação do tipo:
A + B C + D
Ocorrendo no sentido à direita a partir do zero.
Tem-se sempre [A] = [B] e [C] = [D], estando estes valores representados
no gráfico. A constante de equilíbrio da reação será igual a:
2
4
6
8
10 [ ]
caminho da reação
a) 16.
b) 1/4.
c) 4.
d) 5.
e) 1/16.
=
[ C ]
KC
8
x [ D ]
[ A ] x [ B ]
8
4
4
16
64
KC = 4](https://image.slidesharecdn.com/02-230307151752-dcdabe9b/85/_02-ppt-7-320.jpg)





![• Concentração:
– Aumento de concentração desloca o equilíbrio no sentido
oposto da espécie química adicionada .
– Diminuição de concentração desloca o equilíbrio no mesmo
sentido da espécie retirada.
N2O4(g) 2NO2(g)
O aumento da [N2O4] desloca o equilíbrio para a direita
O aumento da [NO2] desloca o equilíbrio para a esquerda
A diminuição da [NO2] desloca o equilíbrio para a direita
A diminuição da [N2O4]desloca o equilíbrio para a esquerda](https://image.slidesharecdn.com/02-230307151752-dcdabe9b/85/_02-ppt-13-320.jpg)





![Referencias
• http://www.uff.br/gqi/ensino/disciplinas/givexp/chatelier.pdf
• http://qnesc.sbq.org.br/online/qnesc21/v21a09.pdf
• http://qnesc.sbq.org.br/online/qnesc05/exper1.pdf
• http://qnesc.sbq.org.br/online/qnesc27/04-ibero-3.pdf
• http://www.spq.pt/boletim/docs/boletimSPQ_100_087_23.pdf
• FELTRE, Ricardo. Fundamentos da Química, volume único. São
Paulo: Moderna,1996. p.351. [Adaptado]
• 1. Química (Ensino médio) I. Canto, Eduardo Leite do. II. Título.
• www.agamenonroberto.com.br
• www.pontociencia.org.br
• http://www.youtube.com/watch?v=N88Vy2-
Q_xs&feature=player_embedded#](https://image.slidesharecdn.com/02-230307151752-dcdabe9b/85/_02-ppt-21-320.jpg)