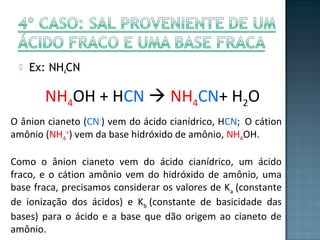
O documento discute três tópicos principais: 1) equilíbrios químicos em soluções aquosas, incluindo grau de ionização e constante de dissociação; 2) autoionização da água e seu efeito em soluções ácidas e básicas; 3) hidrólise salina e como determinar o caráter ácido, básico ou neutro de diferentes sais quando dissolvidos em água.



![Constante de dissociação ou ionização (Kc):
• HCl H+ + Cl- Ka = [H+][Cl-] Ka = 1,0x107
[HCl]
Quando o valor de K é alto, dizemos que o eletrólito
é forte, e o valor de α é próximo de 100%;
• NH4OH NH4
+ + OH- Kb = [NH4
+][OH-] Kb = 1,8*10-5
[NH4OH]
Quando o valor de K é baixo, dizemos que o
eletrólito é fraco, e o valor de α é próximo de 0%.](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-4-320.jpg)
![Tomemos o exemplo do ácido acético.
Considere uma solução do ácido em mols/litro (M).
Temos:
α = _[H+]_ => [H+] = α . M
M](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-5-320.jpg)


![• Equilíbrio iônico na água/produto iônico da água:
A água pua se ioniza segundo a reação:
H2O H+ + OH-Na
verdade, esse processo é mais bem explicado pela auto-ionização da água:
H – O – H + H – O – H H – O – H + OH-H+
Ou 2 H2O H3O+ + OH-O
produto iônico da água é: Kw = 1 x 10-14 (a 25ºC)
Em água pura: [H+] = [OH-] = 10-7](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-8-320.jpg)

![Resumindo, teremos em soluções aquosas
ácidas:
• [H+] aumenta ® [H+] > 10-7
• [OH-] diminui ® [OH-] < 10-7
Desse modo, permanece constante o produto:
Kw = [H+][OH-] = 1 x 10-14
O mesmo ocorre inversamente em soluções
básicas.](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-10-320.jpg)

![ [H+] > [OH-]: pH < 7 meio ácido
[H+] = [OH-]: pH = 7 meio neutro
[H+] < [OH-]: pH > 7 meio básico](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-12-320.jpg)
![pH = - log [H+] e pOH = - log [OH-]
Ex.1: Numa aula prática, alguns grupos mediram o pH da
solução de HCl 0,01 mol.L-1. Considerando que esse ácido
forte é 100% ionizável, sendo, portanto a concentração de H+
igual a 0,01 mol.L-1. Vamos calcular teoricamente o pH dessa
solução.
[H+]=0,01 mol.L-1 pH = - log [H+]
0,01 = 1 x 10-2 pH = - (log 1 x 10-2)
pH = - (log 1 + log 10-2)
sendo log1=0 e log10=1
pH = - (0 +(-2 x log10))
pH = - (-2) pH = 2, logo a solução é ácida](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-13-320.jpg)
![Ex.2: A concentração de OH- no sangue é 2,2 x 10-7 mol.L-1.
Calcule o pH e pOH dessa solução. Sendo que log 2,2 = 0,35.
[OH-]=2,2 x 10-7 mol.L-1 pOH = - log [OH-]
pOH = - (2,2 x 10-7)
pOH = - (log 2,2 + log 10-7)
pOH = - (0,35 +(-7 x log10))
pOH = - (0,35 - 7)
pOH = -(-6,65)
pOH = 6,65
Então, se pH + pOH = 14
pH = 14 – pOH
pH = 14 – 6,65
pH = 7,35 => portanto, o sangue é levemente básico.](https://image.slidesharecdn.com/equilbrioinico-140924135958-phpapp02/85/Equilibrio-ionico-14-320.jpg)