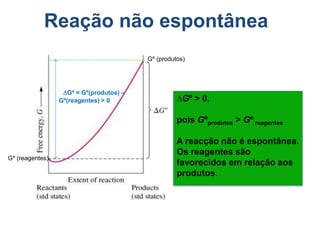
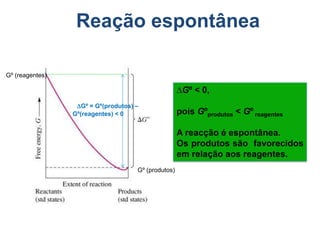
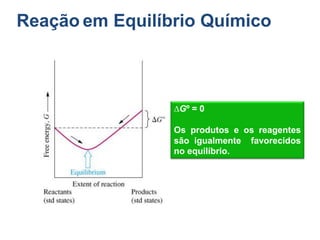
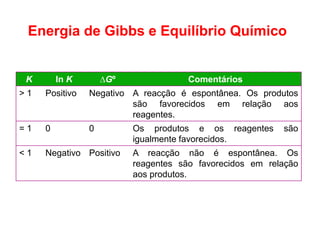
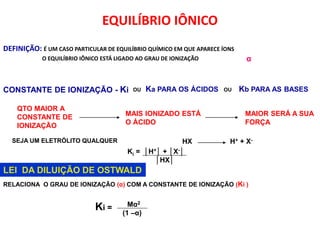
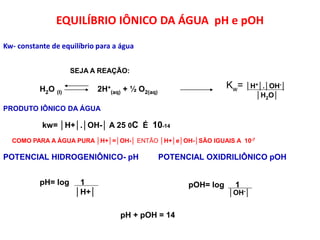
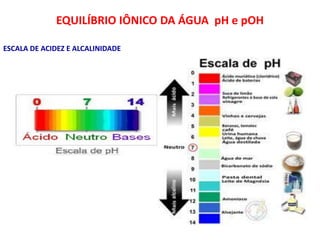
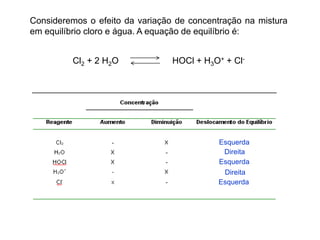
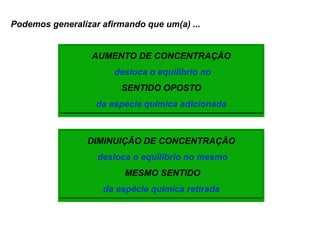
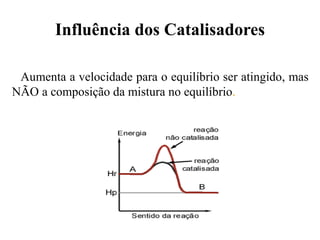
1) O documento discute conceitos de equilíbrio químico, incluindo reversibilidade de reações, velocidades iguais de reações direta e inversa no equilíbrio, e como fatores como temperatura, concentração e pressão afetam o equilíbrio.
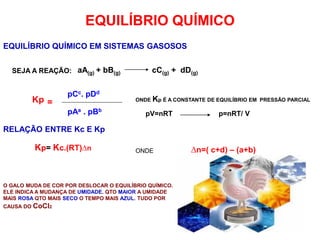
2) É explicado como calcular a constante de equilíbrio Keq usando concentrações ou pressões parciais no equilíbrio.
3) Exemplos ilustram como aplicar esses conceitos para prever o sentido da reação e calcular quant



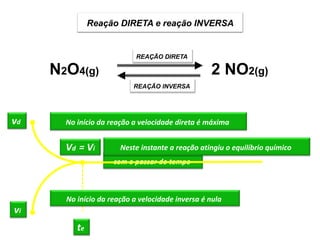

![• No equilíbrio químico ...
1
aA + bB cC + dD
2
K1 = [ C ]c. [ D ]d = kc
V1 = V2 K2 [ A ]a. [ B ] b
K1 .[ A ]a. [ B ]b = K2 .[ C ]c. [ D ]d](https://image.slidesharecdn.com/equilbrioqumico-130227113459-phpapp01/85/Equilibrio-quimico-6-320.jpg)

![K1 = [ C ]c. [ D ]d = kc
K2 [ A ]a. [ B ]b](https://image.slidesharecdn.com/equilbrioqumico-130227113459-phpapp01/85/Equilibrio-quimico-8-320.jpg)




![Medidas de concentração para o sistema abaixo, em
equilíbrio, a uma certa temperatura forneceram os seguintes
resultados:
[ H2 ] = 0,10 mol/L
H2 ( g ) + I2 ( g ) 2 HI ( g ) [ I2 ] = 0,20 mol/L
[ HI ] = 1,0 mol/L
Determine a constante de equilíbrio da reação nestas condições.
( 1,0 ) 2 1,0
KC = = KC = 50
(0,10) x
(0,20) 0,02](https://image.slidesharecdn.com/equilbrioqumico-130227113459-phpapp01/85/Equilibrio-quimico-13-320.jpg)
![04) Foram colocados em um recipiente fechado, de capacidade 2,0 L, 6,5 mol
de CO e 5 mol de NO2. À 200°C o equilíbrio foi atingido e verificou-se que
haviam sido formados 3,5 mol de CO2.
Podemos dizer que o valor de Kc para o equilíbrio dessa reação é:
a) 4,23.
CO + NO2 CO2 + NO
b) 3,84.
c) 2,72. início 6,5 5,0 0,0 0,0
d) 1,96. reage / produz 3,5 3,5 3,5 3,5
e) 3,72.
equilíbrio 3,0 1,5 3,5 3,5
3,5
[ CO2 ] = = 1,75 M [ CO2 ] x [ NO ]
2,0 KC =
[ CO ] x [ NO2 ]
3,5
[ NO ] = = 1,75 M
2,0 1,75 x 1,75
KC =
3,0 1,50 x 0,75
[ CO ] = = 1,50 M
2,0
3,0625
1,5 KC = KC = 2,72
[ NO2 ] = = 0,75 M 1,125
2,0](https://image.slidesharecdn.com/equilbrioqumico-130227113459-phpapp01/85/Equilibrio-quimico-14-320.jpg)




![Influência da Concentração [C]
• ↑ [C] : Equilíbrio deslocado no sentido de consumir
essa substância.
• ↓ [C] : Equilíbrio deslocado no sentido de produzir
essa substância.
Exemplo: N2(g) + 3 H2(g) 2 NH3(g)](https://image.slidesharecdn.com/equilbrioqumico-130227113459-phpapp01/85/Equilibrio-quimico-19-320.jpg)






![A vida a altitudes elevadas e a produção de
hemoglobina
• Consideremos o seguinte sistema em equilíbrio, que representa a
combinação do O2 com a molécula de hemoglobina:
Hb (aq) + O2 (aq) HbO2 (aq)
HbO2 - oxi-hemoglobina que é o composto que transporta realmente o O2
para os tecidos.
A constante de equilíbrio é:
[HbO2 ]
Kc
[Hb][O2 ]
De acordo com o Princípio de Le Châtelier, como evoluirá o
sistema se a ocorrer uma diminuição da concentração de O2?](https://image.slidesharecdn.com/equilbrioqumico-130227113459-phpapp01/85/Equilibrio-quimico-30-320.jpg)