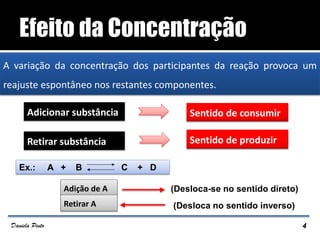
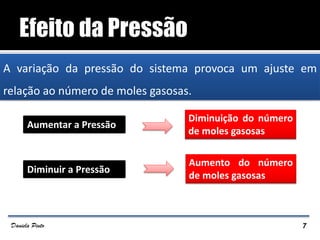
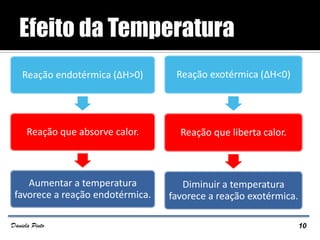
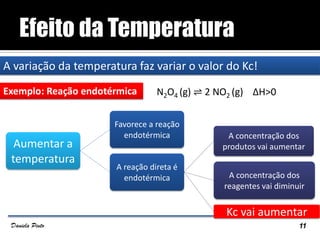
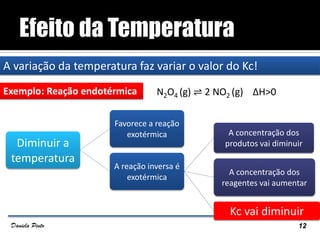
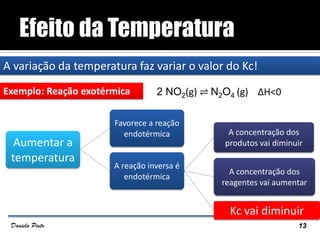
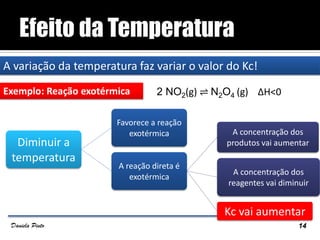
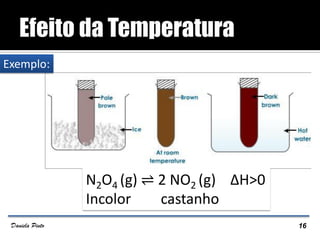
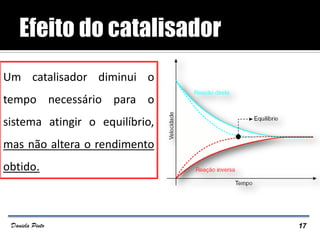
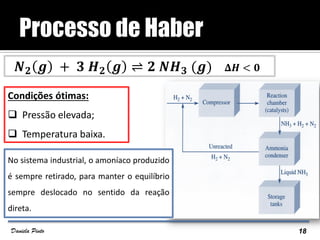
O documento descreve o Princípio de Le Châtelier, que estabelece que quando um sistema químico em equilíbrio é perturbado, ele reage de forma a contrariar a perturbação e retornar a um novo estado de equilíbrio. O equilíbrio químico pode ser alterado variando a concentração dos reagentes, a pressão ou a temperatura do sistema. A direção em que o equilíbrio é deslocado depende do tipo de perturbação aplicada.