O documento discute conceitos fundamentais de cinética química, incluindo:
1) Velocidade de reações e fatores que influenciam como a natureza dos reagentes, concentração e temperatura.
2) Leis de velocidade e como determinar experimentalmente a ordem e constante de velocidade de uma reação.
3) Métodos para deduzir a lei de velocidade e calcular a constante de velocidade usando dados experimentais.




![Prof. Nunes
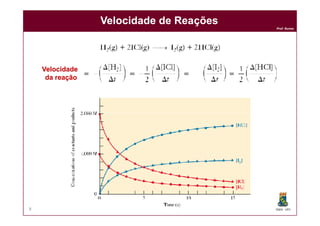
Velocidade de ReaçõesVelocidade de Reações
Vamos estudar a reação: 2 HIVamos estudar a reação: 2 HI(g)(g) HH2(g)2(g) + I+ I2(g)2(g)
Verifica-se que durante um intervalo
de 100s, a concentração molar de HI
decresceu de 4,00M para 3,50M.
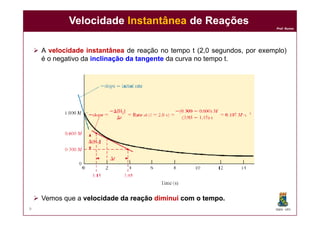
Se a velocidade da reação anterior é
5,0 x 10-3, qual é a velocidade da
reação em termos de [H2]?
DQOI - UFC5
V =
- ( 3,5 - 4,0 )
100s
V = 5,0 x 10-3 mol (HI)
L.s
2 moles HI
são consumidos
1 mol H2
é formado
V = 2,5 x 10-3 mol (H2)
L.s](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-5-320.jpg)









![Prof. Nunes
Plotando as velocidadesvelocidades iniciaisiniciais como uma função da [[NN22OO55]] - ddáá umauma retareta
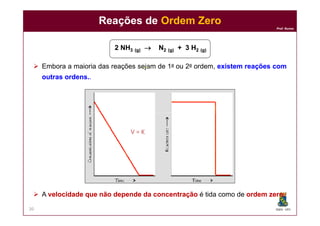
Reações deReações de 1ª Ordem1ª Ordem
2 N2 N22OO5 (g)5 (g) 4 NO4 NO22 (g)(g) + O+ O22 (g)(g)
VV = K . [N= K . [N22OO55]]
DQOI - UFC18
[[NN22OO55]]](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-18-320.jpg)
![Prof. Nunes
Plotando as velocidadesvelocidades iniciaisiniciais como uma função da [NO[NO22]] - nãonão dádá umauma
retareta
Reações deReações de 2ª Ordem2ª Ordem
2 NO2 NO2 (g)2 (g) 2 NO2 NO (g)(g) + O+ O22 (g)(g)
Plotando as velocidadesvelocidades iniciaisiniciais como uma função das [[NONO22]]22 - ddáá umauma retareta.
DQOI - UFC19
[NO[NO22]]22](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-19-320.jpg)


![Prof. Nunes
Podemos usar o métodométodo dasdas velocidadesvelocidades iniciaisiniciais parapara deduzirdeduzir aa leilei dede
velocidadevelocidade experimentalmenteexperimentalmente..
Normalmente conhecemos as concentrações de todos os reagentes no início
da reação. PodemosPodemos, então, medirmedir aa velocidadevelocidade inicialinicial dada reaçãoreação
correspondente a estas concentrações iniciais.
Constante KConstante K –– Determinação ExperimentalDeterminação Experimental
DQOI - UFC23
V = K [A]V = K [A]xx . [B]. [B]yy
V = K [A]V = K [A]xx . [B]. [B]11](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-23-320.jpg)
![Prof. Nunes
Podemos usar o métodométodo dasdas velocidadesvelocidades iniciaisiniciais parapara deduzirdeduzir aa leilei dede
velocidadevelocidade experimentalmenteexperimentalmente..
Normalmente conhecemos as concentrações de todos os reagentes no início
da reação. PodemosPodemos, então, medirmedir aa velocidadevelocidade inicialinicial dada reaçãoreação
correspondente a estas concentrações iniciais.
Constante KConstante K –– Determinação ExperimentalDeterminação Experimental
DQOI - UFC24
V = K [A]V = K [A]xx . [B]. [B]11
V = K [A]V = K [A]11 . [B]. [B]11](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-24-320.jpg)
![Prof. Nunes
Considerando os dados a seguir, determinedetermine aa expressãoexpressão dada leilei dede velocidadevelocidade e
o valor da constanteconstante dede velocidadevelocidade para a reação
Constante KConstante K –– Determinação ExperimentalDeterminação Experimental
DQOI - UFC25
V = K [A]V = K [A]22 . [B]. [B]00 .. [C][C]11
KK = 3.0= 3.0 x 10x 10--44 MM--22 minmin--11](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-25-320.jpg)

![Prof. Nunes
Para reaçõesreações dede 11aa ordemordem, aa concentraçãoconcentração dodo reagentereagente remanescenteremanescente apósapós
umum dadodado intervalointervalo dede tempotempo podepode serser obtidaobtida pelapela seguinteseguinte equaçãoequação::
Velocidade Integrada de 1ª OrdemVelocidade Integrada de 1ª Ordem
[A][A]tt == [A][A]00 .. ee -- k . tk . t
DQOI - UFC27
[A]t = concentração molar de A no tempo t
[A]0 = concentração molar inicial de A
K = constante da reação
t = tempo de reação](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-27-320.jpg)
![Prof. Nunes
Velocidade Integrada de 1ª OrdemVelocidade Integrada de 1ª Ordem
[A][A]tt == [A][A]00 .. ee -- k . tk . t
Note que quantoNote que quanto maior Kmaior K maismais
rápido o decaimentorápido o decaimento..
DQOI - UFC28](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-28-320.jpg)

![Prof. Nunes
Lei de Velocidade IntegradaLei de Velocidade Integrada
[A]t = [A]0 . e- k. t
lnln [A]t = lnln [A]0 + lnln (e(e-- k . tk . t))
lnln [A] = lnln [A] + ((-- k . t )k . t )
lnlnlnln
DQOI - UFC30
lnln [A]t = lnln [A]0 + ((-- k . t )k . t )
lnln [A]t = lnln [A]0 -- kk . t
equação de uma retaequação de uma reta
y = ax + b
coeficiente angular da retacoeficiente angular da reta](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-30-320.jpg)
![Prof. Nunes
Medindo uma Constante de VelocidadeMedindo uma Constante de Velocidade
Quando o ciclopropano é aquecido a 500 oC, ele converte-se em propeno. Os
seguintes dados foram obtidos experimentalmente. DetermineDetermine aa contantecontante dede
velocidadevelocidade dada reaçãoreação..
tempo [C2H6]
0 1,50 x 10-3
5 1,24 x 10-3
ln [C2H6]
- 6,50
- 6,69
DQOI - UFC31
5 1,24 x 10
10 1,00 x 10-3
15 0,83 x 10-3
- 6,69
- 6,91
- 7,09
CoefCoef. da reta = K. da reta = K = (= ( -- 7,02)7,02) –– (( -- 6,56)6,56)
= 13,3= 13,3 –– 1,71,7
KK = 0,040= 0,040 1/min1/min](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-31-320.jpg)
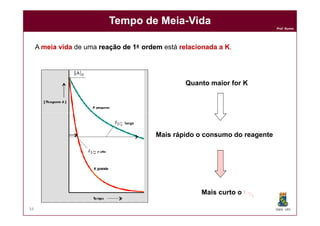
![Prof. Nunes
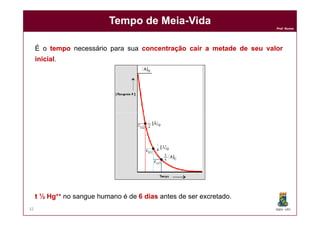
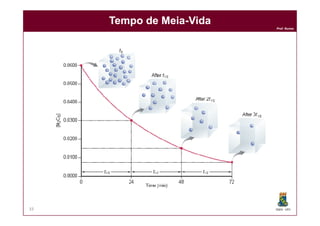
Tempo de MeiaTempo de Meia--VidaVida
lnln [A]t = lnln [A]0 - k . t
lnln [A]t - lnln [A]0 = - k . t
lnln [A]t / [A]0 = - k . t
t1/2 = ln 2
DQOI - UFC35
Quando t = t ½
[A]t1/2 = [A]0 / 2
[A]t1/2 / [A]0 = 1/2
lnln ½ = - k . t1/2
lnln 2 = k . t1/2
t1/2 = ln 2
K
KK tt1/21/2](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-35-320.jpg)

![Prof. Nunes
ExercitandoExercitando
A reação 22 NN22OO55(g)(g) 22 NN22OO44(g)(g) ++ OO22(g(g)) obedece a lei de velocidade = kk [N[N22OO55]], em
que a constante de velocidade específica é 00,,0084000840 ss--11 a uma determinada
temperatura.
a) Se 2,50 moles de N2O5 foram colocados em um recipiente de 5,00 litros a
essa temperatura, quantos moles de N2O5 permaneceram após 1,00
minutos?
b) Quanto tempo seria necessário para que 90% do N2O5 reaja?
DQOI - UFC37
b) Quanto tempo seria necessário para que 90% do N2O5 reaja?](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-37-320.jpg)
![Prof. Nunes
ExercitandoExercitando
22 NN22OO55(g)(g) 22 NN22OO44(g)(g) ++ OO22(g(g)) V= kk [N[N22OO55]] K = 00,,0084000840 ss--11
DQOI - UFC38](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-38-320.jpg)
![Prof. Nunes
ExercitandoExercitando
22 NN22OO55(g)(g) 22 NN22OO44(g)(g) ++ OO22(g(g)) V= kk [N[N22OO55]] K = 00,,0084000840 ss--11
DQOI - UFC39](https://image.slidesharecdn.com/cinetica-110929083017-phpapp01/85/Cinetica-Quimica-39-320.jpg)