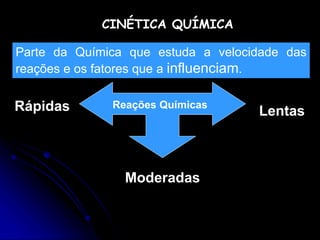
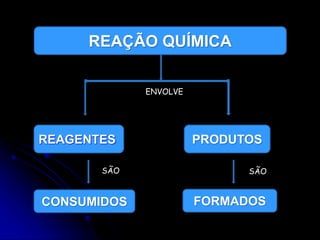
1) A cinética química estuda a velocidade das reações químicas e os fatores que influenciam essa velocidade, como concentração, temperatura e presença de catalisadores.
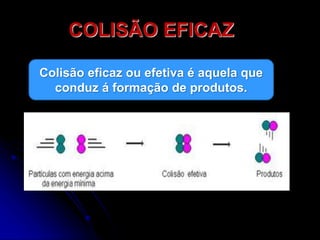
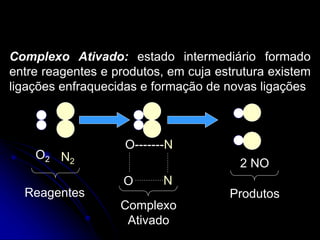
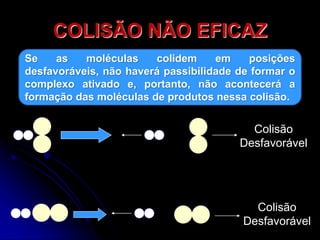
2) A velocidade de uma reação depende da frequência e eficiência das colisões entre as moléculas de reagentes, que formam um complexo ativado intermediário.
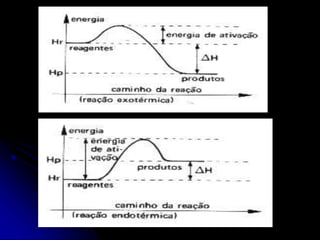
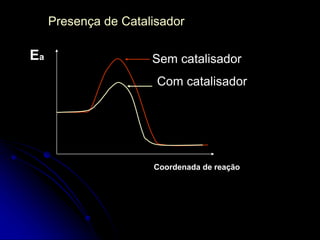
3) A velocidade pode ser aumentada pelo aumento da concentração, temperatura ou presença de catalisadores, que reduzem a energia necessária para a






![ O símbolo [ ] é usado em físico-
química para demostra concentração
em mol/L.
A B
t
[ ]](https://image.slidesharecdn.com/cineticaquimicatrabalho-140610202833-phpapp01/85/Cinetica-quimica-trabalho-12-320.jpg)







![LEI CINÉTICA
É a equação que permite calcular a velocidade de uma
reação a partir das concentrações de reagentes. De forma
genérica:
v = k · [X]m · [Y]n
Onde:
aX + bY -> produtos
k : constante da velocidade da reação, dependente da
temperatura.
[X] e [Y]: concentração dos reagentes X e Y em mol/L
m e n: são expoentes determinados experimentalmente, e
que recebem o nome de "ordem da reação". Assim:
m + n: ordem total da reação](https://image.slidesharecdn.com/cineticaquimicatrabalho-140610202833-phpapp01/85/Cinetica-quimica-trabalho-23-320.jpg)
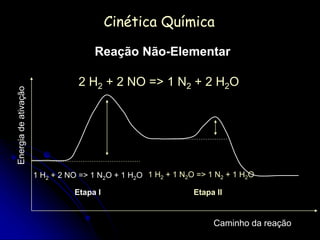
![Reação Elementar
Quando a reação química se desenvolve em uma única
etapa, dizemos que a reação é elementar.
Numa reação elementar, os expoentes a que devem ser
elevadas as concentrações dos reagentes na expressão
da velocidade são os próprios coeficientes dos
reagentes na equação balanceada
1 H3O+ + 1 OH- => 2 H2O
V = k [H3O+] [OH-]](https://image.slidesharecdn.com/cineticaquimicatrabalho-140610202833-phpapp01/85/Cinetica-quimica-trabalho-24-320.jpg)