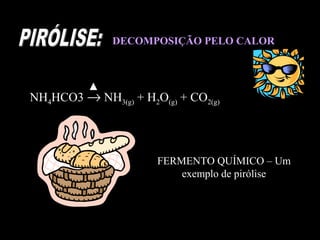
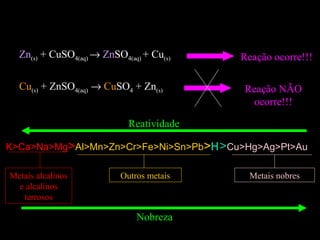
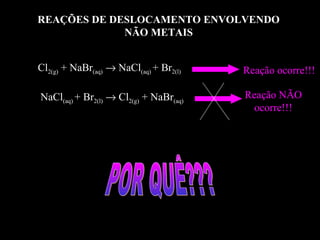
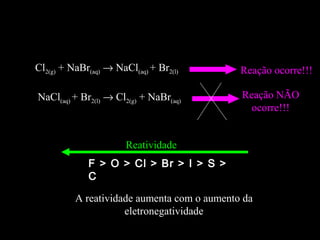
As reações químicas fazem parte do nosso dia-a-dia e podem ser identificadas por efeitos como saída de gases, formação de precipitado ou mudança de cor. A gasolina reage com o oxigênio do ar em uma reação exotérmica que libera energia e faz o carro se movimentar. Diferentes tipos de reações incluem composição, decomposição e trocas.