O documento discute equilíbrio químico em soluções aquosas, incluindo:
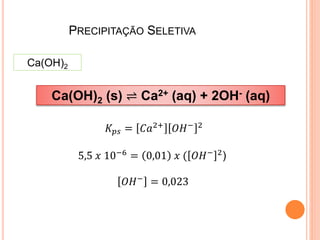
1) Equilíbrio de solubilidade de sais pouco solúveis e como a presença de íons comuns afeta a solubilidade.
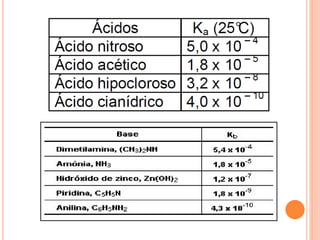
2) Equilíbrio ácido-base, incluindo definições de ácidos e bases, constantes de acidade e basicidade (Ka, Kb, Kw), e relação entre pH e pOH.
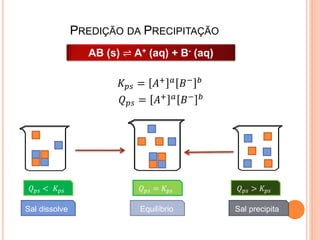
3) Previsão da precipitação de sais com base nos valores de Kps e Qps.


![𝐾 𝑝𝑠 = constante do produto de solubilidade
O produto de solubilidade é a constante de equilíbrio entre um
sal não-dissociado e seus íons em uma solução saturada.
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
𝐾 𝑝𝑠 =[𝐴𝑔+][𝐶𝑙−]
Ag+
Cl-
AgCl (s)](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-4-320.jpg)
![SOLUBILIDADE
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
𝐾 𝑝𝑠 = 1,8. 10−10
𝐾 𝑝𝑠 =[𝐴𝑔+
][𝐶𝑙−
]
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
[𝐴𝑔+]= S [𝐶𝑙−] = S
S S
𝐾 𝑝𝑠 =𝑆. 𝑆
𝑆2
=1,8. 10−10 𝑆 =1,3. 10−5
M
Se encontrarmos a solubilidade das espécies encontramos o
número máximo de mols de AgCl que podem ser dissolvidos em 1L
de água.](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-5-320.jpg)

![SOLUBILIDADE NA PRESENÇA DE ÍON COMUM
Qual a solubilidade do AgCl em uma solução 1,0 𝑥 10−2 𝑀 de AgNO3?
𝐾𝑝𝑠 = 𝐴𝑔+
𝐶𝑙−
𝐴𝑔+
= 𝐴𝑔+
𝑑𝑜 𝐴𝑔𝑁𝑂3
+ 𝐴𝑔+
𝑑𝑜 𝐴𝑔𝐶𝑙
1,0 𝑥 10−2 𝑀
1,3 𝑥 10−5
𝑀
Ag+ Cl-
AgCl (s)
𝐴𝑔+ = 1,3 𝑥 10−5
𝑀
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
[𝐴𝑔+]= S [𝐶𝑙−] = S
𝑆 =1,3. 10−5M
𝑆 =1,3. 10−5M](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-7-320.jpg)








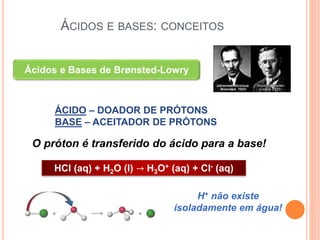
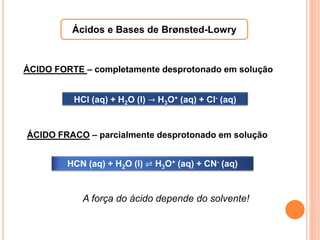
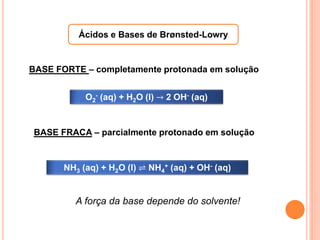

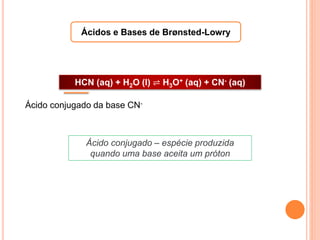
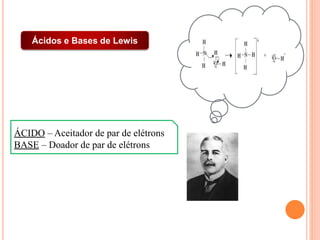
![CONSTANTES DE ACIDEZ E BASICIDADE
𝐻𝐴 + 𝐻2 𝑂 ⇄ 𝐻3 𝑂+
+ 𝐴−
𝐾𝑎=
𝐻3 𝑂+ [𝐴 −
]
[𝐻𝐴]
B + 𝐻2 𝑂 ⇄ 𝐻𝐵+
+ 𝑂𝐻 −
𝐾𝑏=
𝐻𝐵+ [𝑂𝐻 −
]
[𝐵]
Uma base
abstrairá os
prótons de
qualquer ácido,
inclusive a água.
A maneira de compararmos a
força de um ácido é por meio de
sua tendência em transferir um
próton para uma mesma base,
geralmente a água.](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-25-320.jpg)
![A ESCALA DE PH
pH = -log [H3O+] pOH = -log [OH-]
• Para a água pura, a molaridade dos íons H3O+ é
1,0 𝑥 10−7 𝑚𝑜𝑙 𝐿−1, em 25°C. Seu pH será:
pH = -log [H3O+] = -log (1,0 x 10-7) = 7,0](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-26-320.jpg)

![A AUTO-IONIZAÇÃO DA ÁGUA
2 H2O ⇌ H3O+ + OH-
CONSTANTE DO PRODUTO IÔNICO DA ÁGUA- Kw
Solução neutra a 25°C:
[H3O+] = [OH-] = 1,00 x 10-7 M
pH = pOH = 7,00
pH + pOH = pKw = 14,00](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-28-320.jpg)
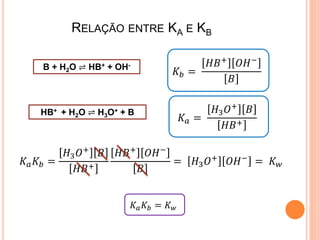
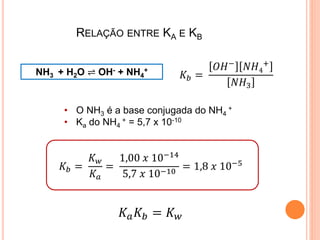







![EQUAÇÃO DE HENDERSON-HASSELBALCH
𝑝𝐻 = 𝑝𝐾 𝑎 + 𝑙𝑜𝑔
[𝑏á𝑠𝑖𝑐𝑜]𝑖𝑛𝑖𝑐𝑖𝑎𝑙
[á𝑐𝑖𝑑𝑜]𝑖𝑛𝑖𝑐𝑖𝑎𝑙](https://image.slidesharecdn.com/aula2-140521160723-phpapp01/85/Aula2-38-320.jpg)