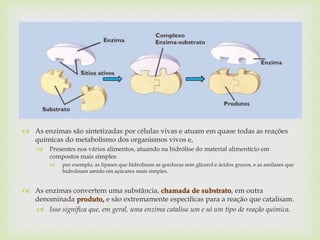
O documento discute o histórico, definição, propriedades e aplicações das enzimas. As enzimas são proteínas que catalisam reações químicas, acelerando processos metabólicos e digestivos. Sua especificidade e funções são essenciais para a vida, e aplicações industriais incluem a produção de alimentos e bebidas.



![
Descreveu a Fermentação do açúcar em álcool pela levedura era catalisada por
fermentos
Postulando que esses fermentos (as enzimas) eram inseparáveis da
estrutura das células vivas do levedo;
Estabeleceu o conceito de que as enzimas eram células vivas.
Químico francês Louis Pasteur
(1822-1895)
Louis Pasteur (1822-1895)
Justus von Liebig (1803-1873)
• Químico alemão Justus von Liebig (1803-1873)
afirmou que a fermentação era provocada por
substâncias químicas.
• Denominação enzima [do grego énsimo (ενζυμο),
formado de én = em e simo = fermento ou
levedura] foi dada, em 1878, pelo fisiologista
alemão Alexander Friedrich Khune.](https://image.slidesharecdn.com/aulaenzimascta2015-150826115313-lva1-app6892/85/Enzimas-4-320.jpg)