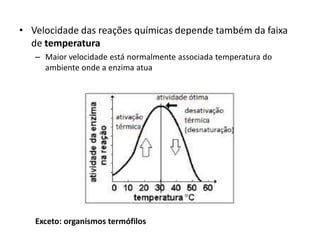
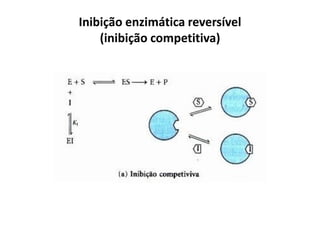
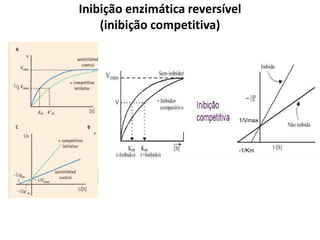
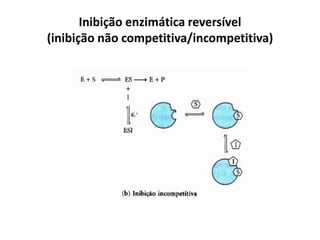
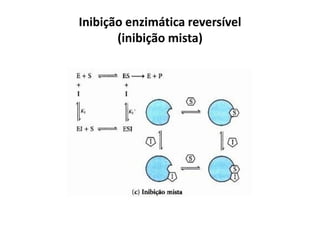
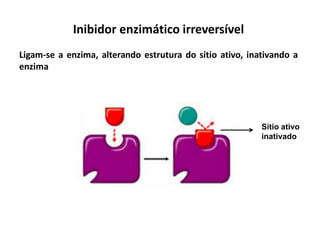
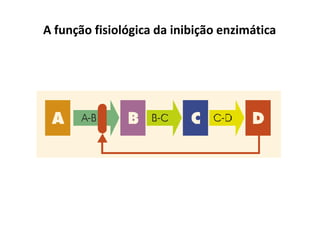
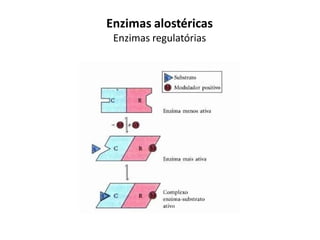
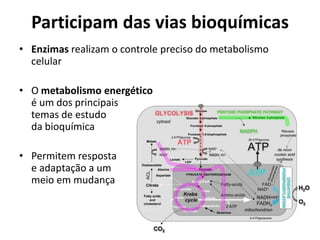
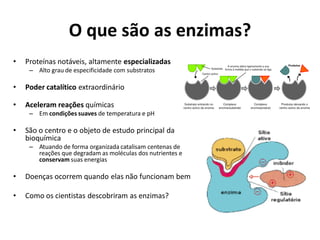
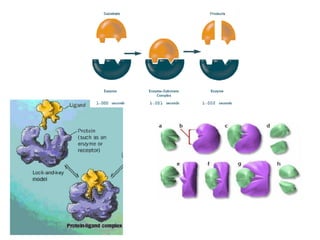
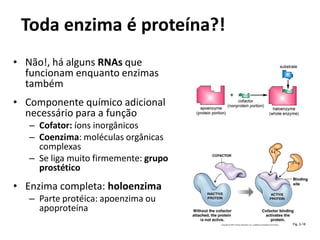
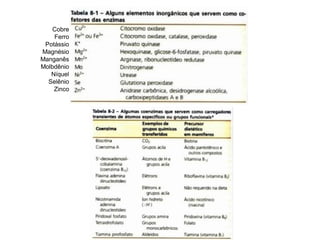
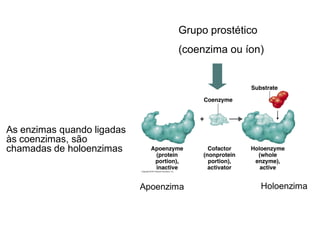
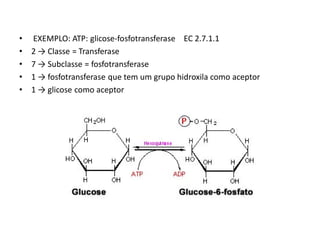
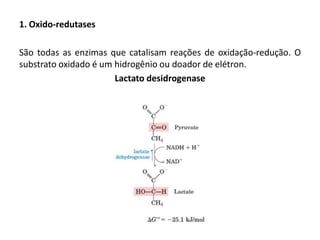
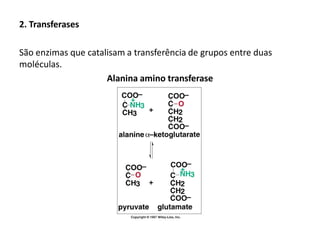
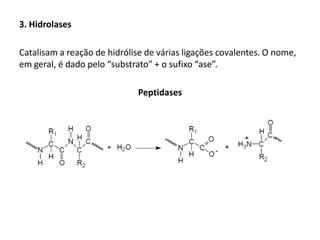
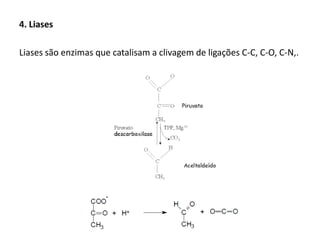
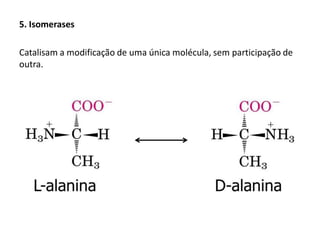
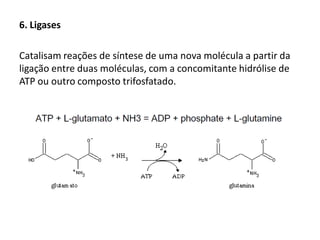
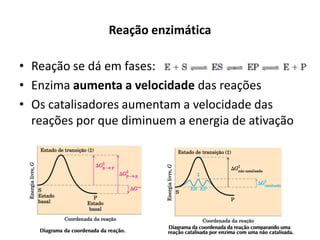
Este documento discute as enzimas, proteínas que catalisam reações químicas no corpo. Ele começa explicando o que são enzimas e seu papel fundamental no metabolismo celular antes de resumir a história da descoberta de enzimas, incluindo os trabalhos iniciais de Pasteur, Fischer e Sanger. O documento também discute a estrutura, classificação, cinética e regulação de enzimas.














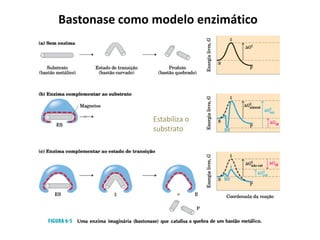
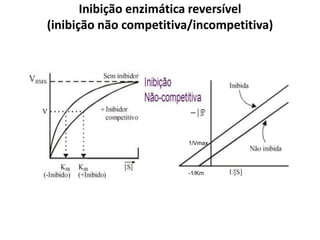
![Cinética enzimática
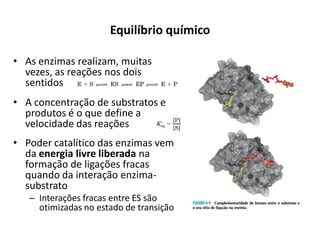
• A concentração do substrato [S] influi
na velocidade das reações catalisadas
por enzimas
• Velocidade máxima é abstraída para
concentrações excessivas de
Substrato
• Constante de Michaelis-Menten
– kM = [S] correspondente a ½
Vmax;
V0](https://image.slidesharecdn.com/enzimasfsp1completo-150219125624-conversion-gate02/85/Enzimas-31-320.jpg)

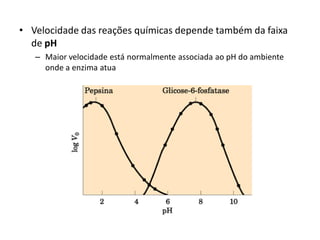
![Efeito do pH na atividade enzimática
H+
H+
A. pH ótimo
B. pH inferior ao
ótimo (maior [H+])](https://image.slidesharecdn.com/enzimasfsp1completo-150219125624-conversion-gate02/85/Enzimas-36-320.jpg)