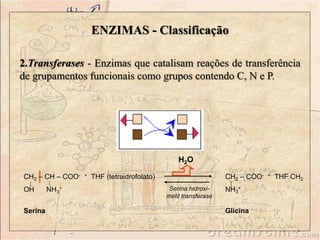
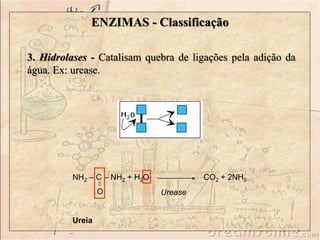
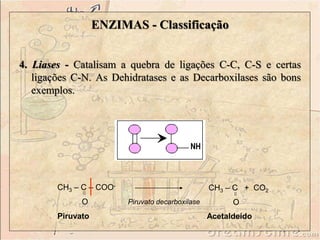
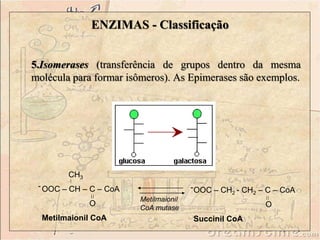
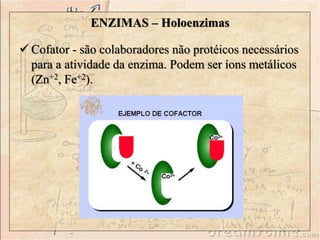
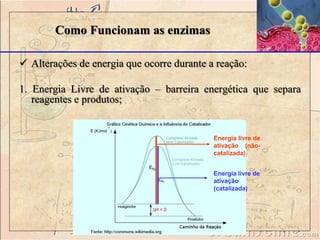
Enzimas são catalisadores biológicos feitos de proteínas que aceleram reações químicas sem serem consumidas. Elas possuem alta especificidade e eficiência e são essenciais para o metabolismo celular. A atividade enzimática pode ser afetada por fatores como concentração do substrato, temperatura, pH e presença de inibidores.










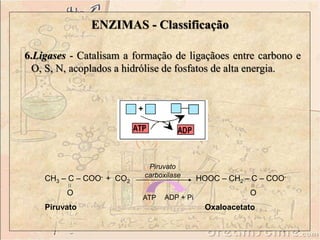
![ENZIMAS - Classificação
1. Oxidorredutases - São enzimas que catalisam reações de
transferência de elétrons, ou seja: reações de oxi-redução. São
as Desidrogenases e as Oxidases.
+ NAD+
[R]
[O] + NADH + H
Lactato
desidrogenase](https://image.slidesharecdn.com/enzimas-141112091604-conversion-gate01/85/Enzimas-11-320.jpg)





![Equação de Michaelis-Menten
modelo da cinética de Michaelis-Menten
K1
K2
E + S ES E + P
K1
K1 e K2 = contante de velocidade
Equação: Descreve como a velocidade da reação varia de acordo
com a concentração do substrato.
V0 = Vmax [S]
Km + [S]
V0 = velocidade inicial de reação
Vmax = velocidade máxima
Km = constante de Micaelis = (K1 +K2 K1)
[S] = concentração do substrato](https://image.slidesharecdn.com/enzimas-141112091604-conversion-gate01/85/Enzimas-31-320.jpg)
![Conclusões importantes sobre a cinética de
Michaelis-Menten
Km reflete a afinidade da enzima ao substrato;
Cada enzima possui um Km característico para um dado
substrato;
Km é numericamente igual a [S] em que a velocidade da reação
é igual a ½ Vmáx.;
– Um Km pequeno reflete a afinidade elevada da enzima ao
substrato;
– Km grande – baixa afinidade;](https://image.slidesharecdn.com/enzimas-141112091604-conversion-gate01/85/Enzimas-32-320.jpg)
![Conclusões importantes sobre a cinética de
• Se [S] é menor do que Km a velocidade da reação é
proporcional a [S]. Quando [S] maior do que Km a velocidade
é igual a Vmax.
• Se a [E] reduzir pela metade a velocidade inicial é reduzida
pela metade;
• A velocidade da reação que independe da [S] é chamada de
ordem zero.
Michaelis-Menten](https://image.slidesharecdn.com/enzimas-141112091604-conversion-gate01/85/Enzimas-33-320.jpg)
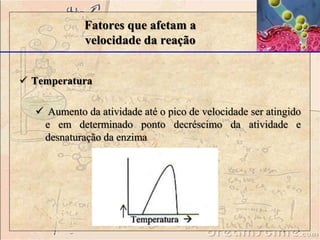
![Fatores que afetam a
velocidade da reação
Concentração do substrato
- Velocidade da reação: catalisadas por enzimas aumenta
conforme a concentração do substrato (velocidade de reação (v)
aumenta com o acréscimo de [S]. μM/min).
-modelo da cinética de Michaelis-Menten de uma reação
demosntra um formato hiperbólico da curva de V versus [S].](https://image.slidesharecdn.com/enzimas-141112091604-conversion-gate01/85/Enzimas-34-320.jpg)