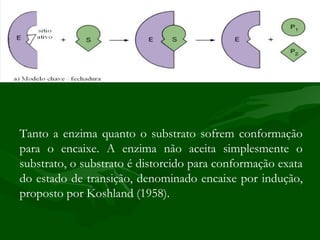
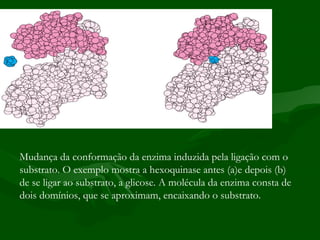
1) As enzimas são proteínas que catalisam reações biológicas sem interferir no processo, aumentando sua velocidade. Elas são classificadas de acordo com o tipo de reação catalisada.
2) A cinética enzimática estuda como fatores como a concentração do substrato influenciam a velocidade da reação catalisada. A saturação da enzima ocorre quando a taxa se torna independente da concentração do substrato.
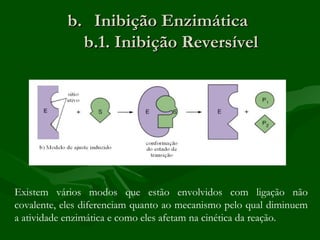
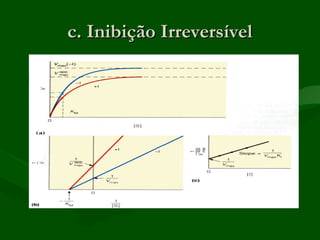
3) Enzimas podem ser inibidas de forma reversível ou irreversível, competitiva ou não competitiva




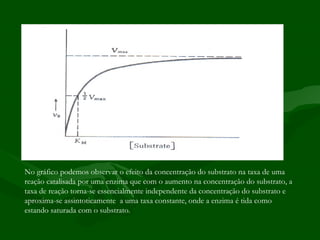
![PONTO DE SATURAÇÃO
• Todas as enzimas apresentam o efeito da
saturação, porém variando consideravelmente
no que diz respeito à concentração requerida
para produzi-lo.
Equação que nos permite demonstrar
V max[S ] como a velocidade de uma reação varia
V =
0
Km + [S ] em função da concentração do substrato.](https://image.slidesharecdn.com/enzimas-121029082446-phpapp02/85/Enzimas-7-320.jpg)