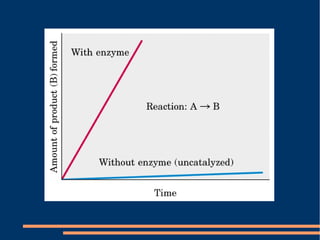
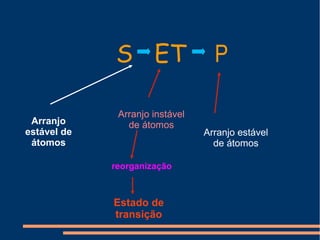
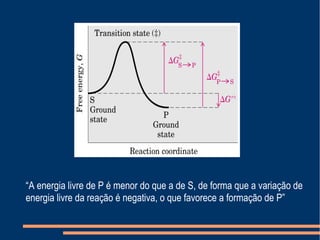
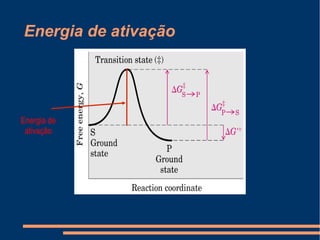
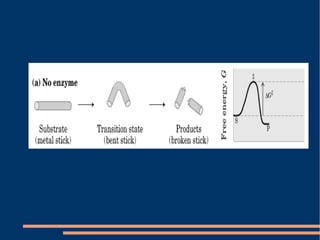
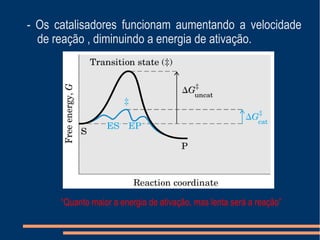
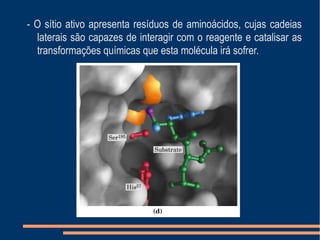
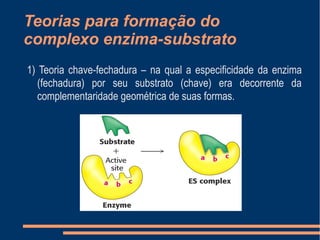
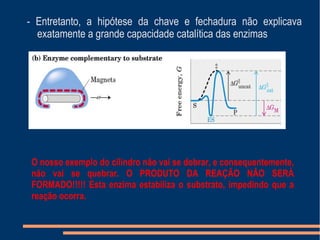
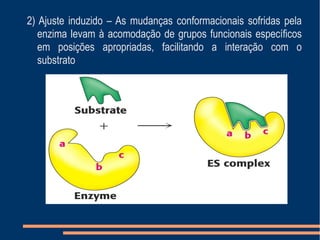
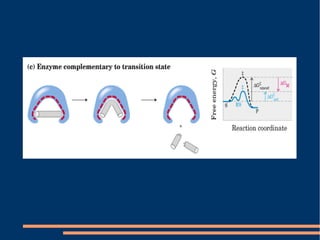
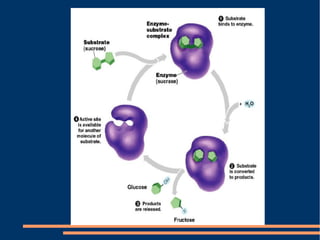
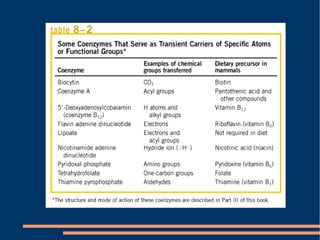
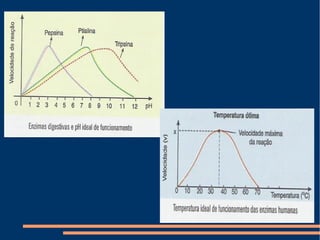
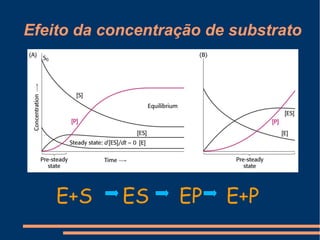
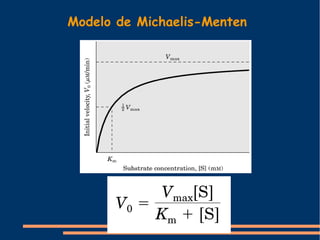
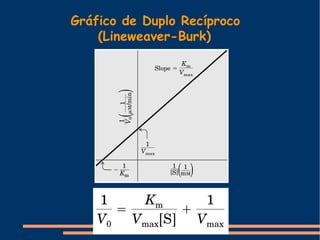
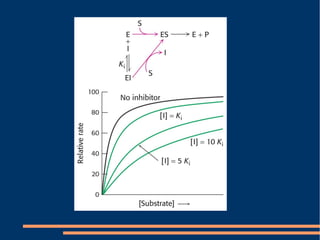
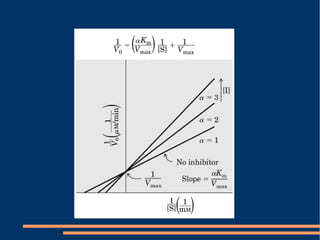
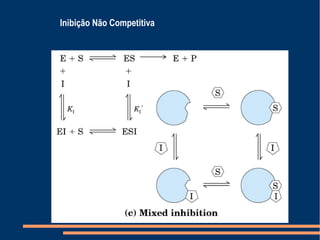
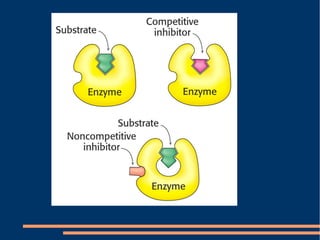
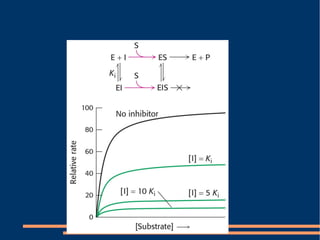
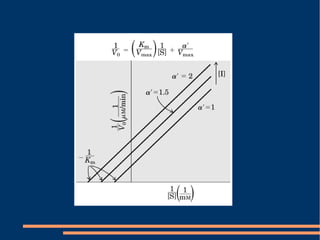
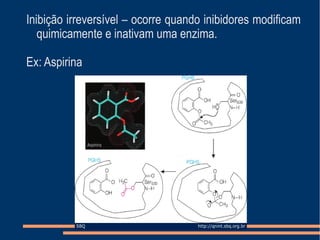
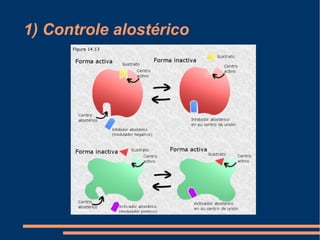
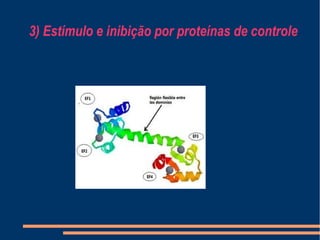
O documento descreve a natureza química das enzimas, resumindo que: (1) as enzimas são proteínas que catalisam reações químicas a taxas muito mais rápidas do que sem catalisador; (2) as enzimas funcionam por interação específica com substratos em seu sítio ativo, reduzindo a energia de ativação da reação; (3) a cinética enzimática estuda como fatores como concentração de substrato e pH afetam a velocidade da reação enzimática.