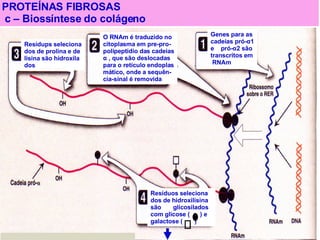
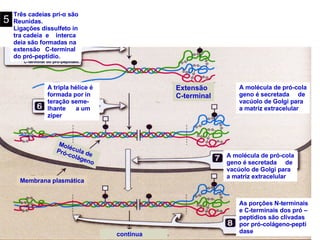
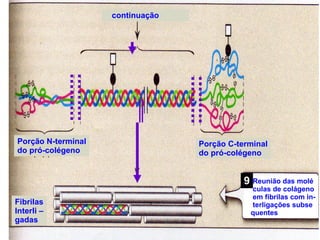
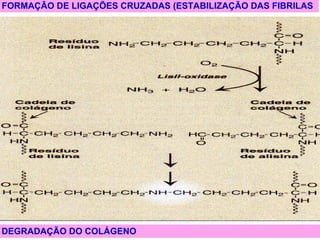
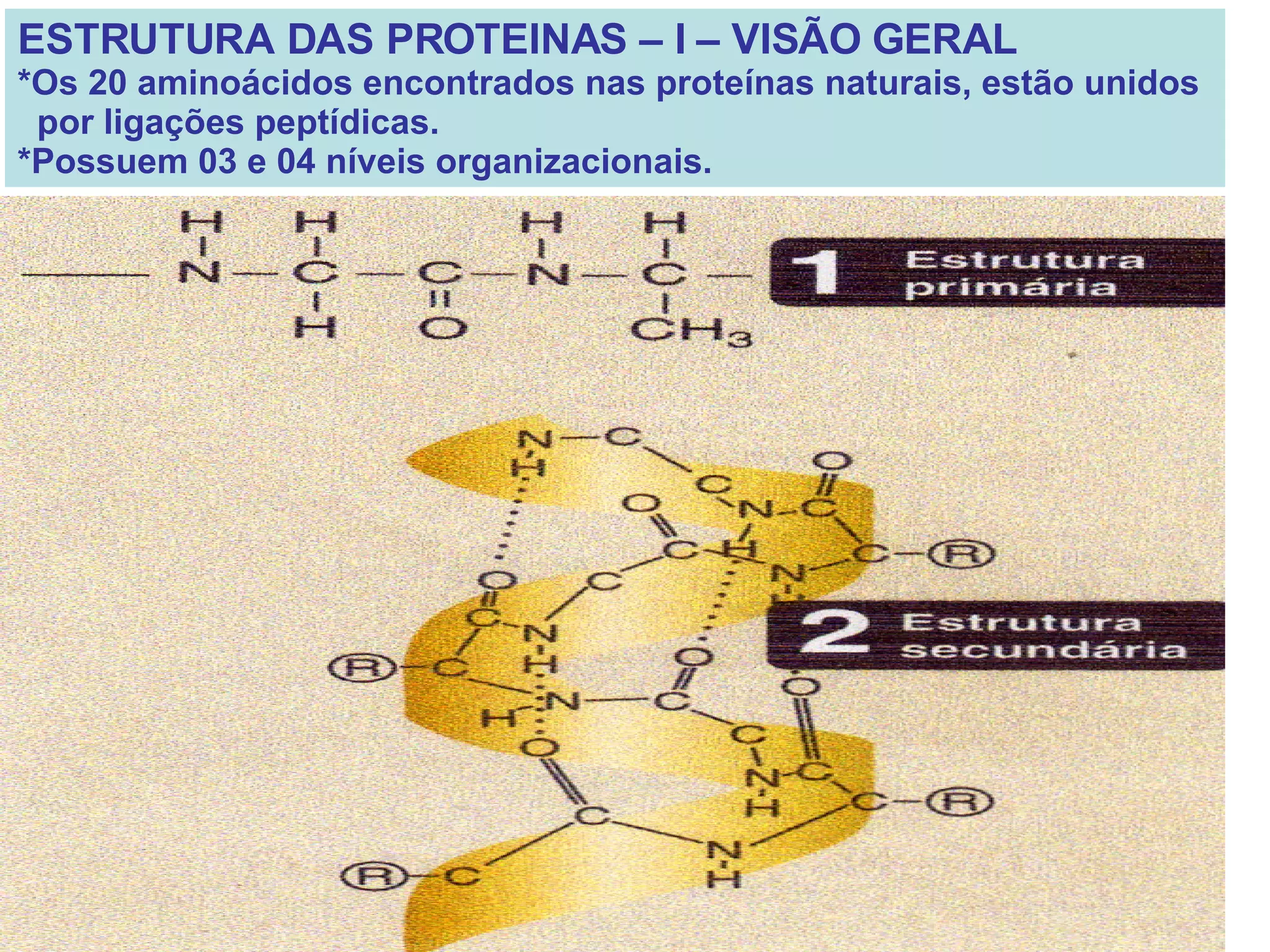
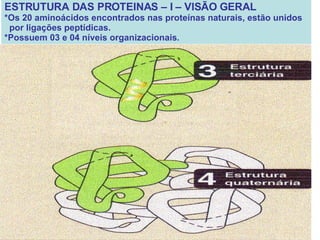
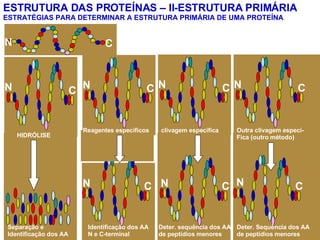
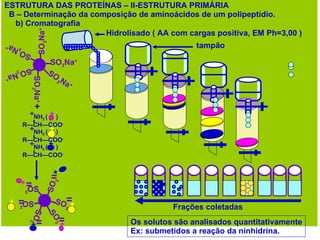
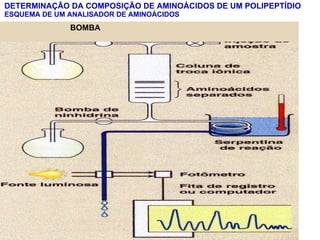
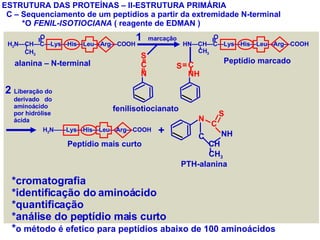
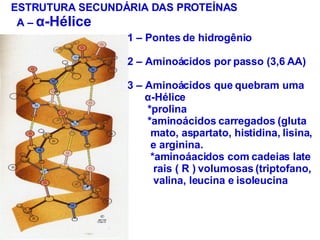
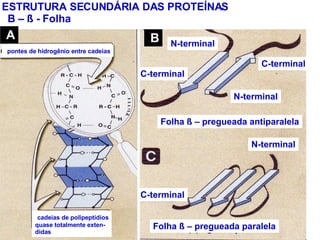
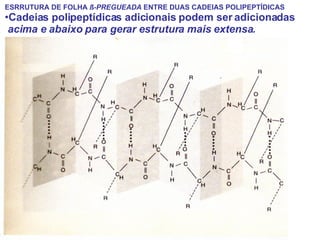
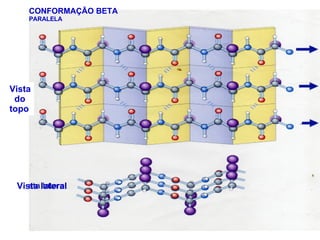
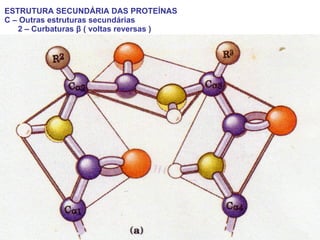
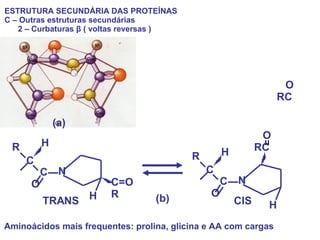
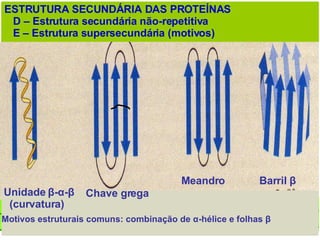
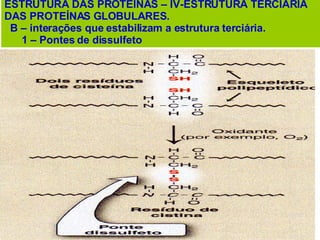
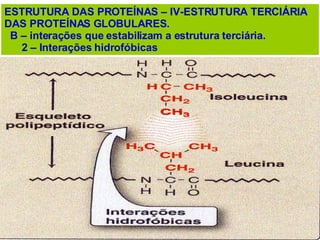
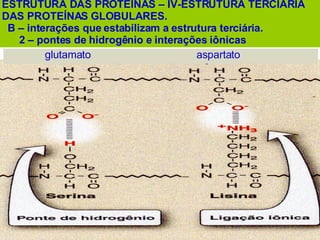
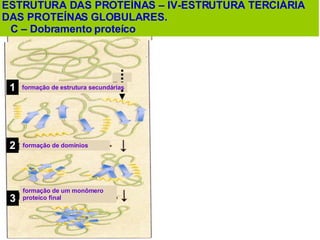
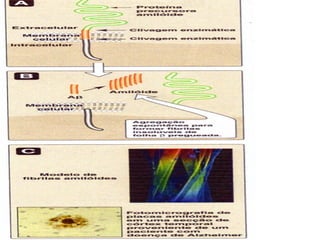
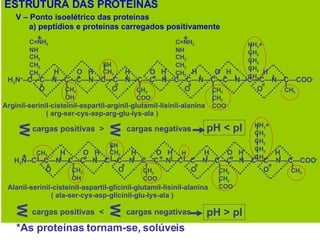
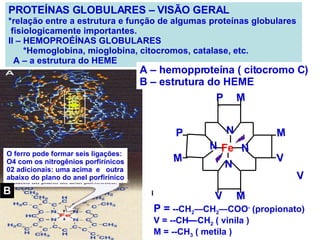
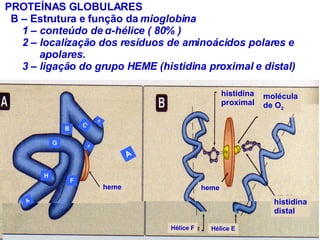
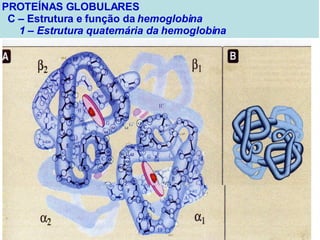
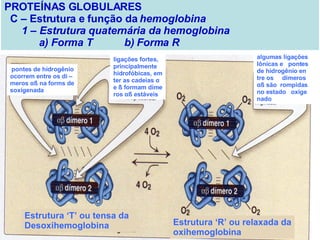
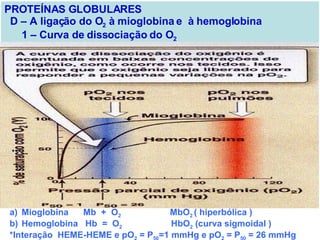
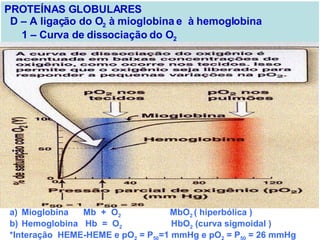
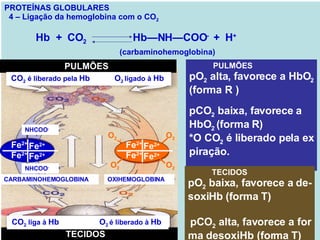
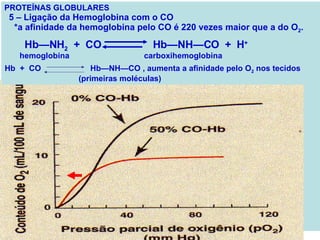
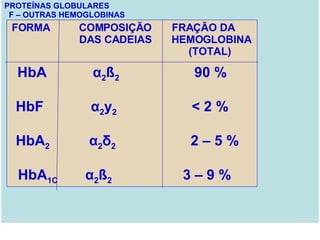
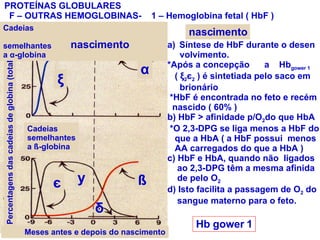
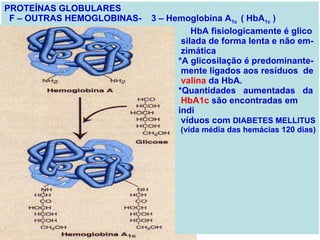
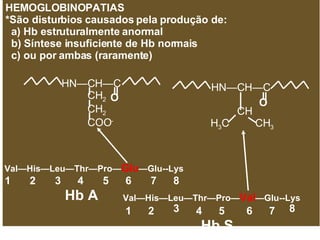
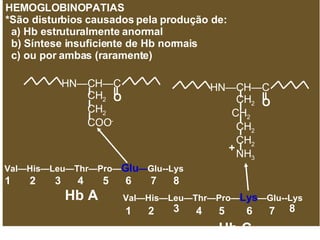
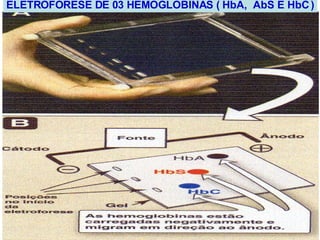
O documento discute a estrutura de proteínas em diferentes níveis de organização, incluindo estrutura primária, secundária, terciária e quaternária. Ele também descreve como as proteínas globulares como a mioglobina e a hemoglobina se dobram para ligar oxigênio, usando estruturas como alfa-hélice e folhas beta.









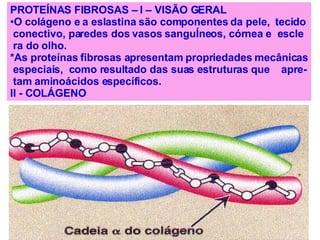
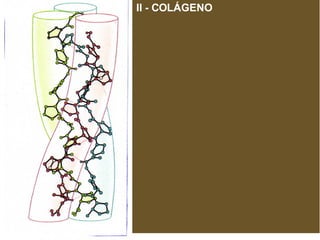
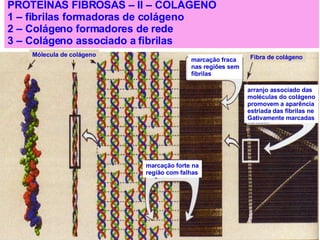
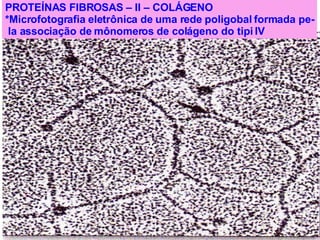
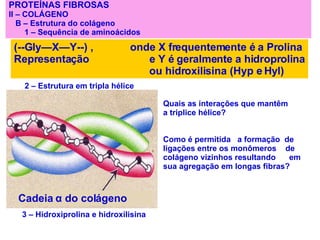
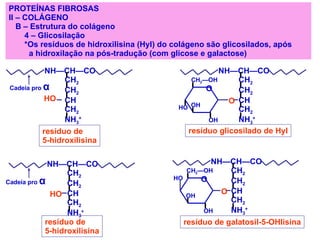
![PROTEÍNAS FIBROSAS – II - COLÁGENO * Tipos mais abundantes de colégeno A – Tipos de colágeno *A superfamília inclui mais de 20 tipos de colágeno. TIPO CADEIAS DISTRIBUIÇÃO TECIDUAL formados por fibrilas I α 1(I) 2 α 2(I) Pele, ossos, tendões, vasos sanguí neo, córnea II [ α 1(II)] 3 Cartilagem, disco intervertebral, cor po vítreo III [ α 1(III)] 3 Vasos sanguíneos, pele fetal. formados de rede IV [ α 1(IV)] 2 α 2(IV) Membrana basal VII Abaixo do epitélio estratificado esca moso associado a fibrila IX Cartilagem XII Tendões, ligamentos, outros tecidos Tipos mais abundantes de colégeno](https://image.slidesharecdn.com/protenas-i-e-ii-1220895751289613-9/85/Proteinas-I-e-II-54-320.jpg)