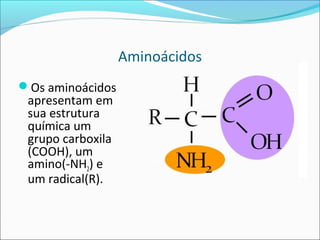
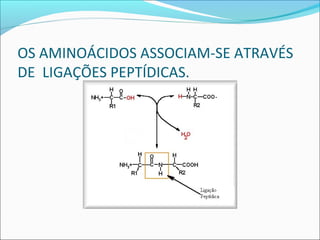
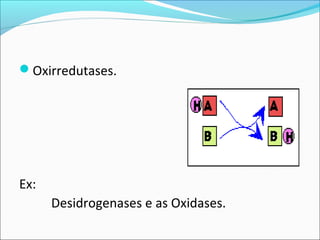
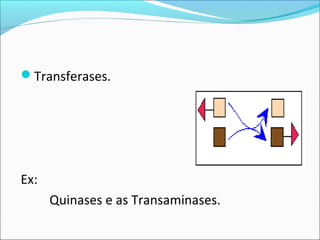
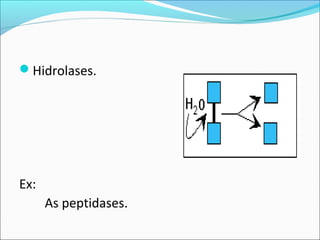
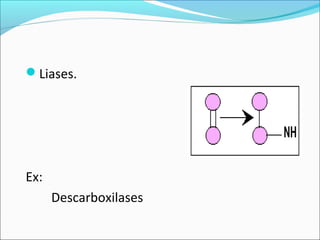
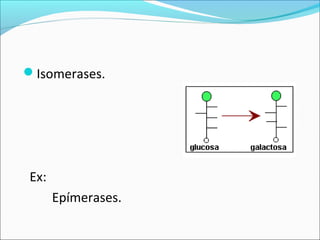
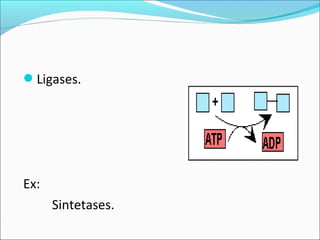
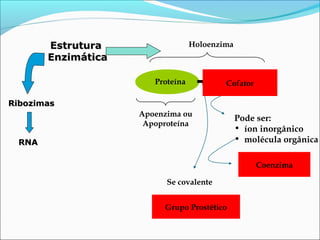
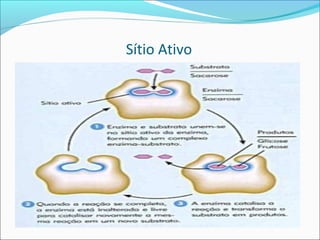
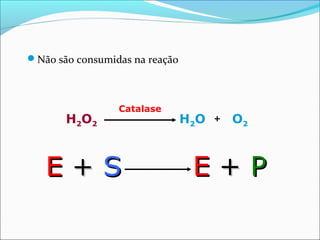
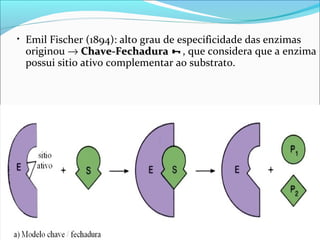
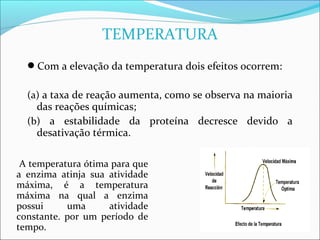
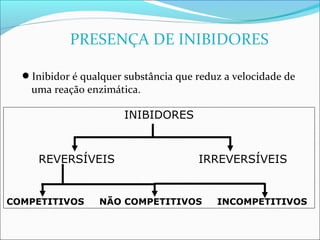
O documento define enzimas como catalisadores biológicos formados por cadeias de aminoácidos que viabilizam reações celulares. As enzimas são classificadas em 6 tipos e possuem estrutura composta por proteína e cofator. Fatores como pH, temperatura e concentração de substrato influenciam a atividade enzimática.