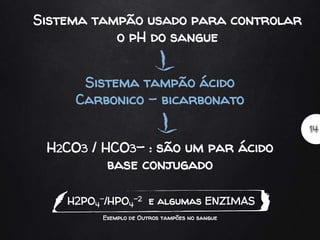
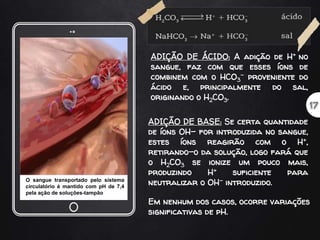
O documento discute soluções tampão, definindo-as como soluções que resistem bem a variações de pH quando pequenas quantidades de ácido ou base são adicionadas. Explica que sistemas biológicos usam soluções tampão para regular o pH e manter a homeostase ácido-base, dando exemplos de tampões no sangue como o sistema carbônico-bicarbonato.




![A solução tampão dá conta de gastar todo o H+ ou
OH- adicionado, impedindo bruscas variações de pH.
HCL
0,1 molL-1
HCL
0,1 molL-1
NH4CL NH4 + CL-
NH3 + H2O NH4 + OH-
Obs:
A adição de H+ aumenta a [NH4+]
A adição de OH- aumenta a [NH3 +]
A base adicionada reage com o
CH3COOH formando o CH3COO-
CH3COOH CH3COO-
A acido adicionado reage com o
CH3COO- formando o CH3COOH](https://image.slidesharecdn.com/soluotampo-160625215650/85/Solucao-tampao-6-320.jpg)



![Tampão ácido fraco/ânion do ácido
Tampão base fraca/cátion da base
poH = pKb + log [sal]
[base]
EQUAÇÃO DE HENDERSON HASSELBALCH
►pK se refere ao logaritmo negativo de uma constante de equilíbrio
. Quando K aumenta, sua função p decresce e vice-versa.
► quanto maior o Ka e menor o pKa mais forte é o ácido.](https://image.slidesharecdn.com/soluotampo-160625215650/85/Solucao-tampao-10-320.jpg)