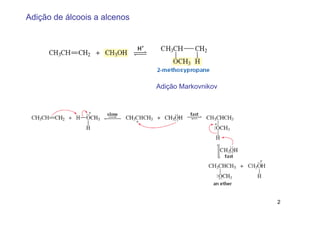
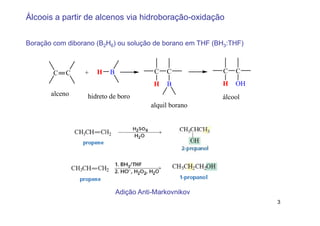
1) A adição de álcoois a alcenos ocorre preferencialmente segundo a regra de Markovnikov, enquanto a hidroboração-oxidação ocorre anti-Markovnikov.
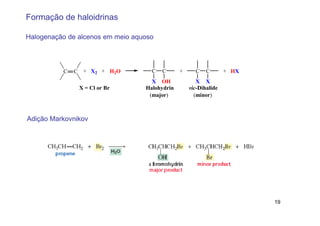
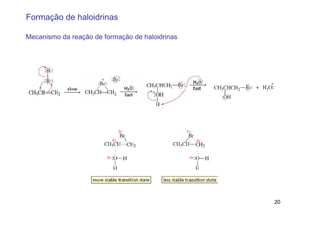
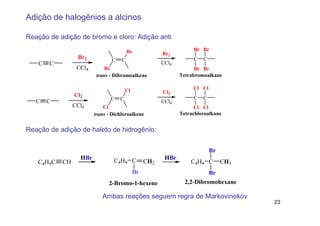
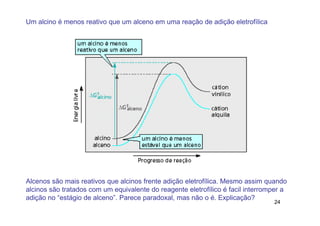
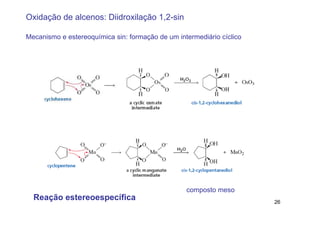
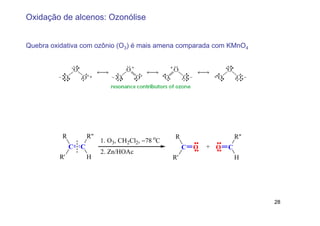
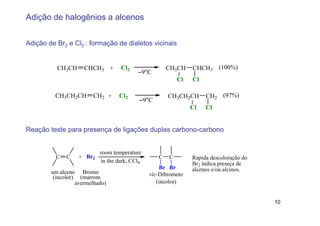
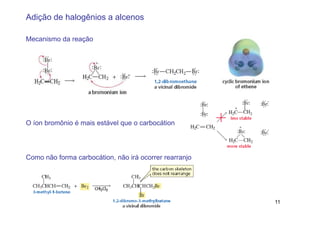
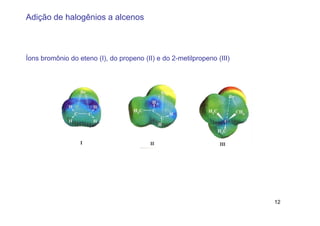
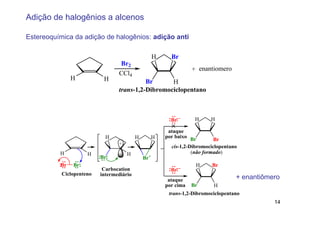
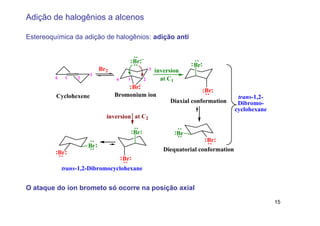
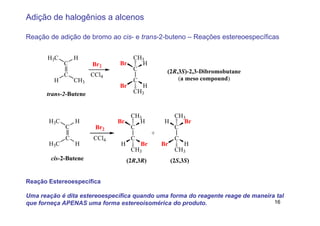
2) A adição de halogênios a alcenos ocorre segundo uma reação estereoespecífica de adição anti, formando vic-dihalogênios.
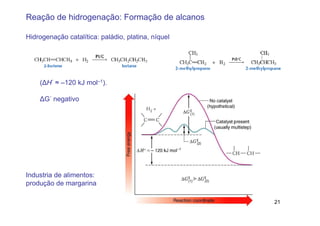
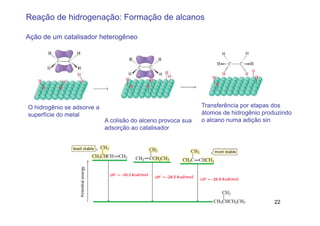
3) A hidrogenação catalítica de alcenos conduz à formação de alcanos correspondentes em uma reação exotérmica.




![Adição de halogênios a alcenos
Mecanismo da adição de bromo ao cis-2-buteno
Br HCH
3
(a) C C
H
Br − H3C Br
(a) (b)
H H (2R,3R-)2,3-Dibromobutano
H H H3C CH3
C C C C
H3C CH3 Br
Br H
+
H3C
δ+ Br (b) C C
íon bromônio H
δ− Br (aquiral) Br CH3
(2S,3S)-2,3-Dibromobutano
(quiral)
adição do bromo ao cis-2-buteno O íon bromônio reage com o brometo
forma um íon bromônio aquiral. em proporção igual pelos caminhos (a) e
[Reação pela outra face formaria o (b) para formar mistura racêmica.
mesmo íon bromônio]
17](https://image.slidesharecdn.com/aula8-reaodealcenosii-121215164439-phpapp02/85/Aula-8-reacao-de-alcenos-ii-17-320.jpg)
![Adição de halogênios a alcenos
Mecanismo da adição de bromo ao trans-2-buteno
Br CH3
(a) H
C C
Br − H
(a) (b) H3C Br
H CH3
H CH3 H3C (R,S-)2,3-Dibromobutano
C C C C H (meso)
H3C H
Br Br
δ+ Br + H
íon bromônio (b) H3C
C C
δ− Br (quiral) CH
Br H 3
(R,S)-2,3-Dibromobutano
(meso)
adição do bromo ao trans-2-buteno O íon bromônio reage com o brometo
forma um íon bromônio quiral. em proporção igual pelos caminhos (a) e
[Reação pela outra face formaria o (b), porém forma o mesmo composto
enantiômero do íon bromônio] aquiral meso [reação do outro
enantiômero do íon bromônio irá
formar os mesmos produtos].
18](https://image.slidesharecdn.com/aula8-reaodealcenosii-121215164439-phpapp02/85/Aula-8-reacao-de-alcenos-ii-18-320.jpg)