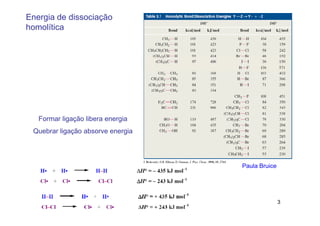
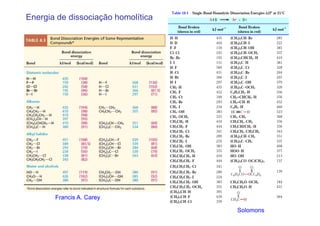
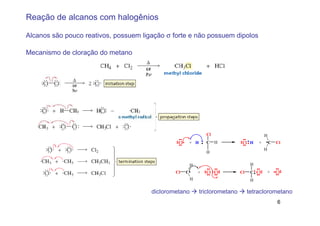
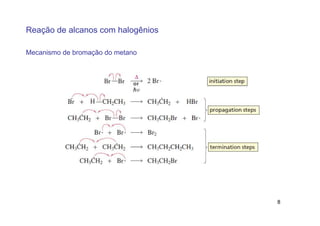
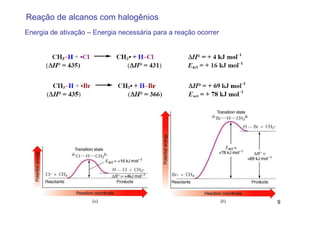
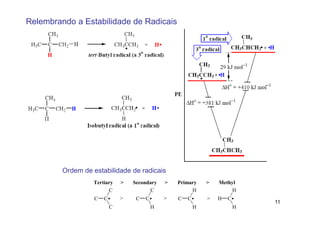
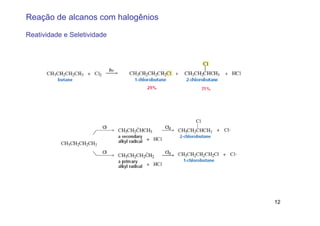
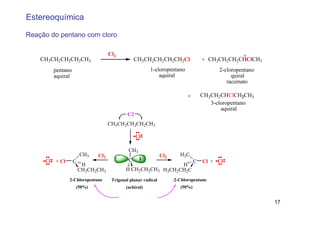
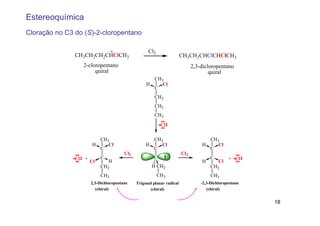
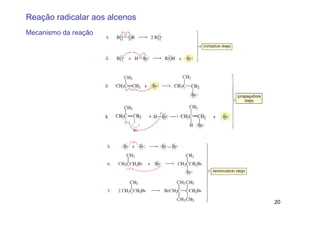
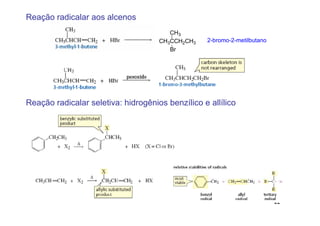
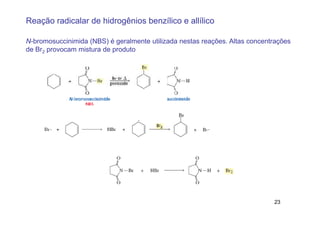
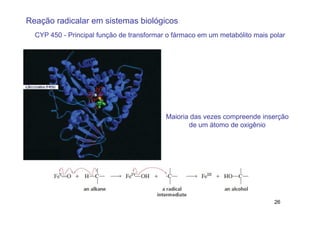
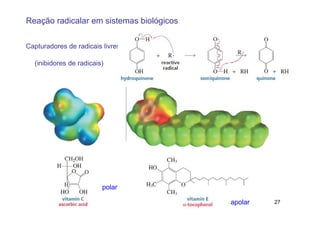
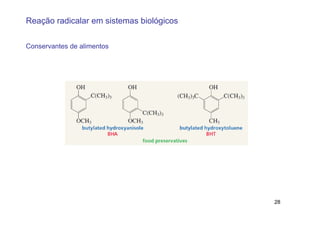
O documento discute reações radicais, incluindo a formação de radicais por homólise, a energia necessária para quebrar e formar ligações, e mecanismos de reação de alcanos e alcenos com halogênios. A seletividade entre radicais cloro e bromo é explicada pela entalpia de ligações quebradas e formadas e energia de ativação.