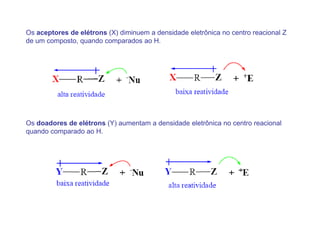
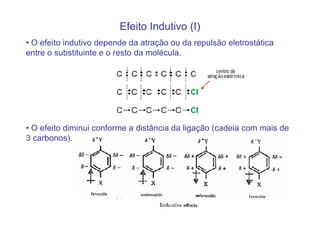
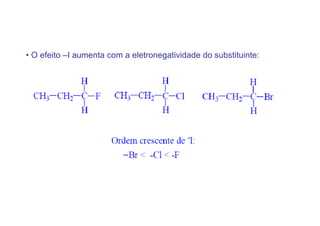
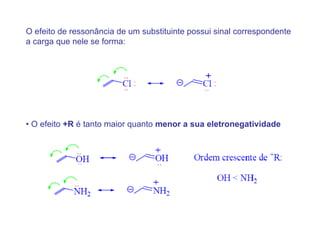
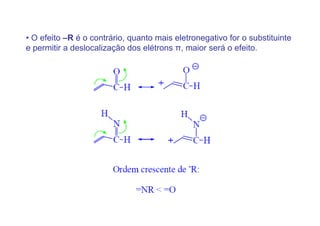
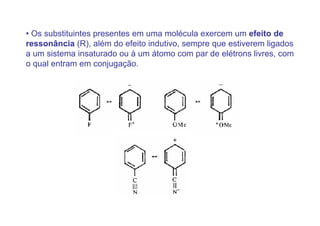
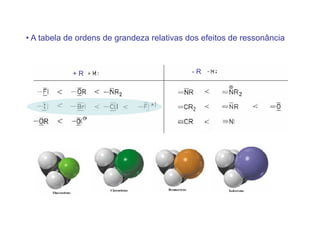
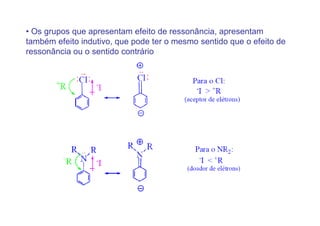
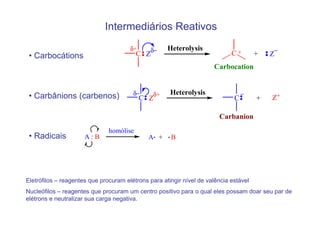
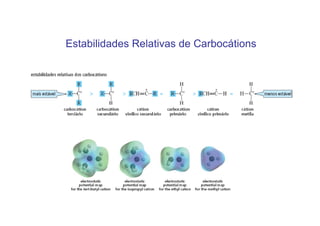
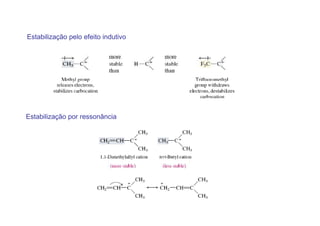
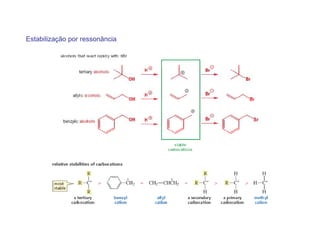
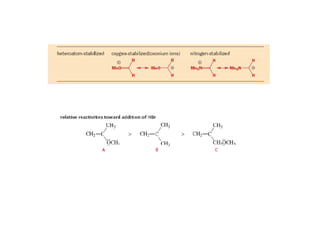
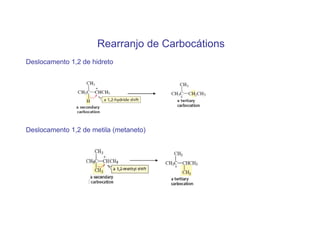
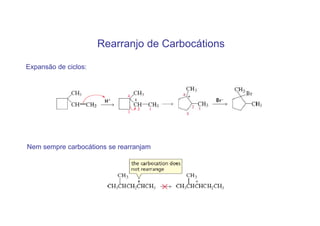
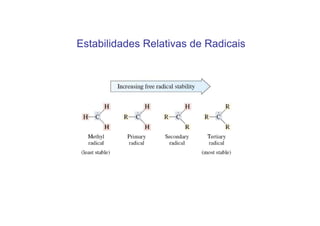
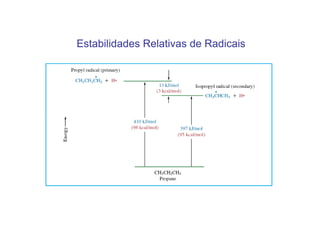
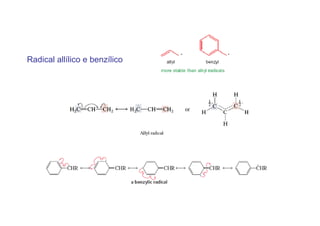
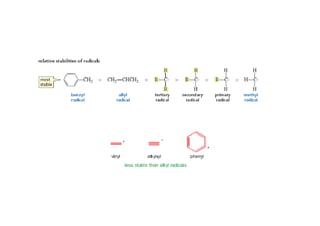
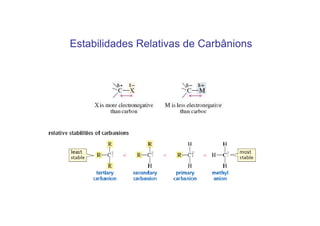
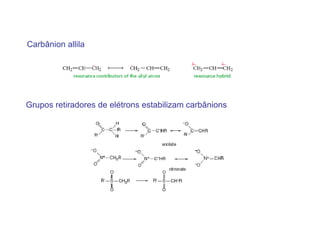
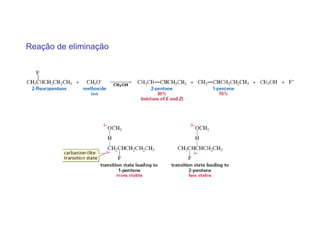
O documento discute os efeitos eletrônicos dos substituintes em moléculas orgânicas e como eles influenciam a reatividade. Os substituintes podem ser doadores ou aceptores de elétrons, afetando a densidade eletrônica do centro reacional. Esses efeitos ocorrem por indução ou ressonância e dependem da eletronegatividade do substituinte. Intermediários como carbocátions, carbânions e radicais livres são discutidos em termos de sua estabilidade.