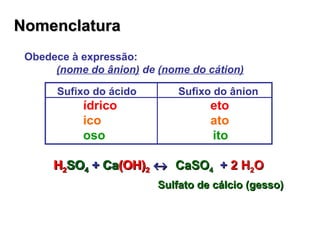
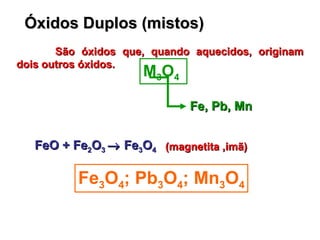
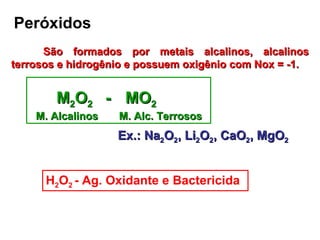
1) O documento descreve diferentes tipos de sais e óxidos, suas propriedades e usos. 2) Sais são compostos formados pela reação de ácidos e bases, enquanto óxidos são compostos formados por ligação iônica entre oxigênio e outro elemento. 3) Alguns sais e óxidos importantes descritos incluem o bicarbonato de sódio, o óxido de zinco e o peróxido de hidrogênio.