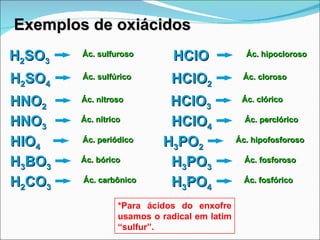
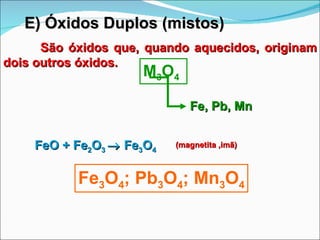
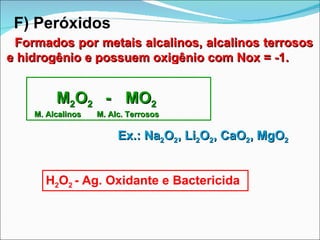
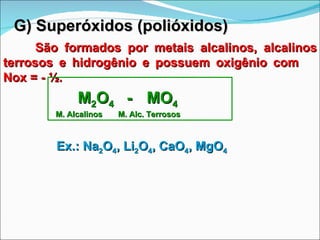
O documento descreve as principais funções inorgânicas: ácidos, bases, sais e óxidos. Ácidos liberam íons hidrogênio em solução aquosa e apresentam sabor azedo. Bases liberam íons hidroxila e apresentam sabor cáustico. Sais formam-se pela neutralização de ácidos e bases e dissociam-se em íons em solução aquosa. Óxidos podem ser ácidos, básicos, anfóteros ou neutros dependendo de sua reatividade com água e outros reagentes.