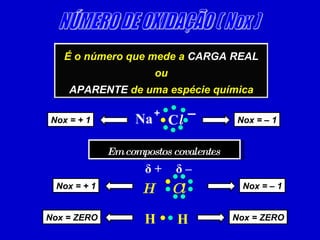
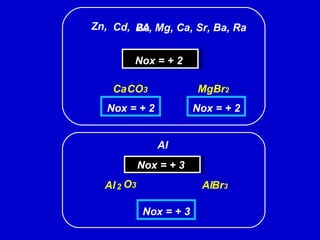
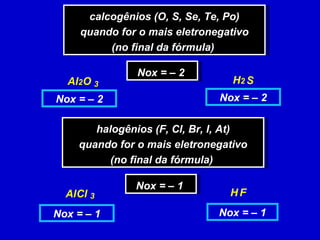
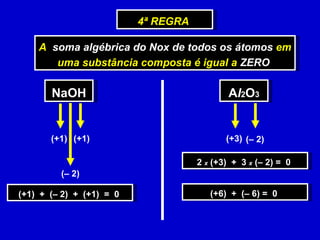
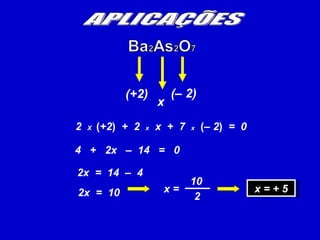
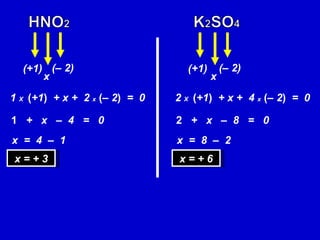
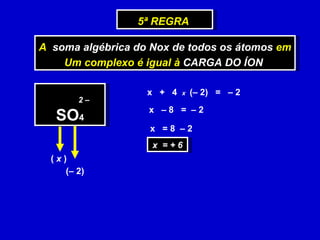
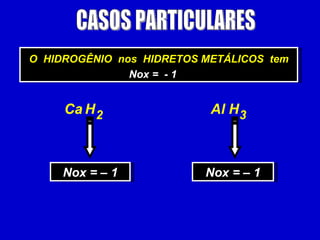
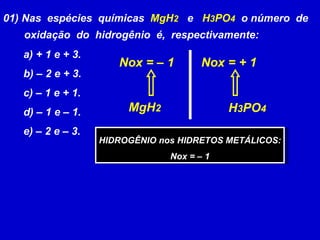
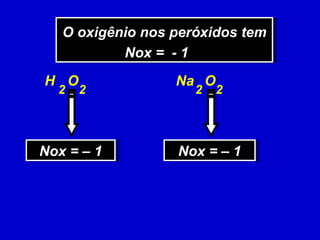
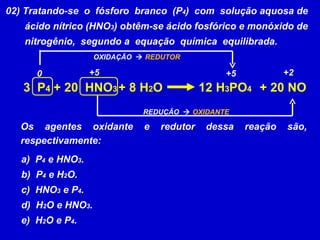
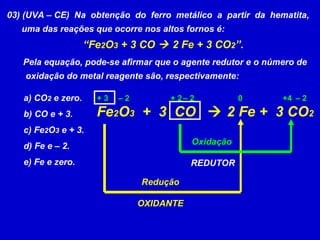
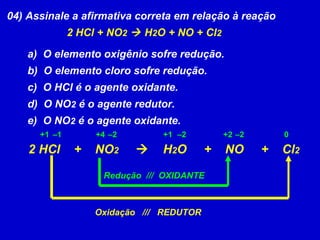
O documento explica os conceitos de oxidação, redução e número de oxidação (Nox). Apresenta regras para calcular o Nox em diferentes tipos de compostos e casos especiais como hidrogênio em hidretos metálicos e oxigênio em peróxidos. Também define agentes oxidantes e redutores em reações redox.