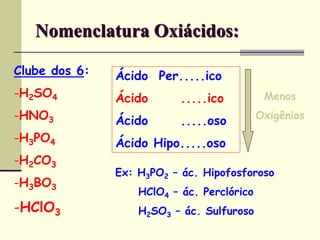
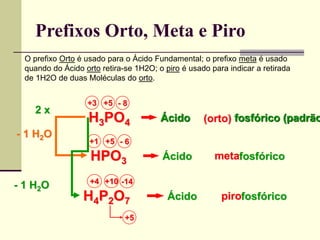
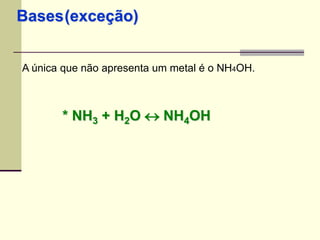
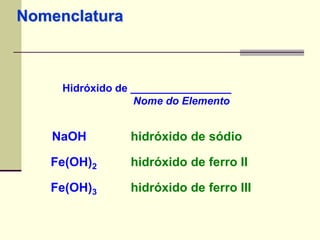
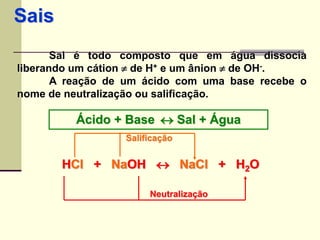
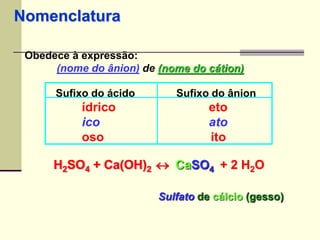
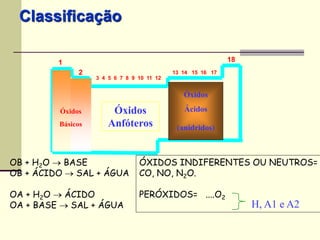
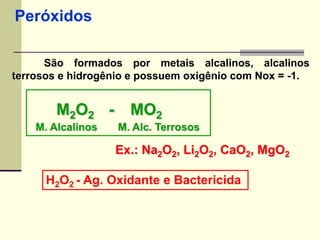
O documento discute os principais tipos de compostos ácidos, bases e sais. Apresenta as definições de ácido, base e sal segundo Arrhenius e discute exemplos importantes como o ácido sulfúrico, ácido clorídrico, hidróxido de sódio e bicarbonato de sódio. Também aborda a classificação, nomenclatura e propriedades gerais desses compostos.