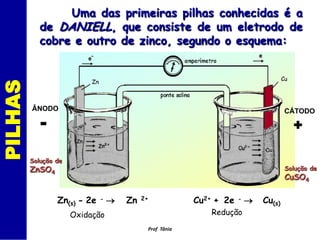
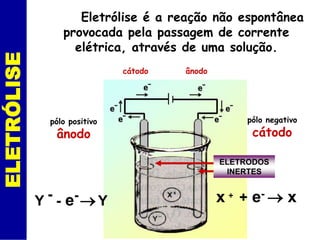
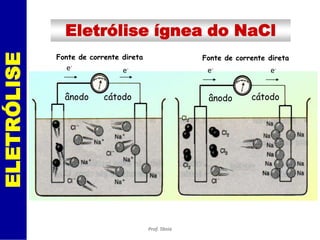
O documento discute os processos de eletrólise e pilhas. Ele define eletrólise como reações provocadas por corrente elétrica e pilhas como reações que produzem corrente elétrica. Ele fornece exemplos de como a eletrólise separa íons em eletrodos e como a pilha de Daniell funciona com eletrodos de cobre e zinco.