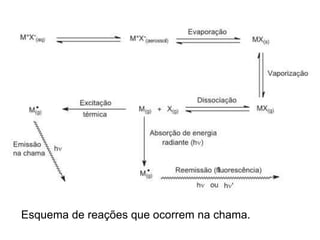
A apresentação descreve métodos para identificar os cátions Cu2+ e Bi3+ em uma solução desconhecida. Testes com K4[Fe(CN)6], NH4OH e uma prova de chama confirmaram a presença de Cu2+ ao formar precipitados castanho, azul e coloração verde na chama respectivamente. Testes com NH4OH, NaOH e KI não indicaram a presença de Bi3+.










![4. Reagentes
- Água destilada
- Ácido acético;
- Soluções aquosas de:
- CuSO4 0,25 mol/L;
- K4[Fe(CN)6] 0,2 mol/L
- NH4OH 6,0 mol/L
- HCl 6,0 mol/L
- NaOH 1,0 mol/L
- H2O2 concentrado
- KI 0,5 mol/L
- Solução desconhecida](https://image.slidesharecdn.com/aps-150312140343-conversion-gate01/85/Identificacao-dos-cations-Cu2-e-Bi3-11-320.jpg)






![5. Procedimento e Resultados
5.2 Identificação do Cu2+
5.2.1 Reação com K4[Fe(CN)6]
Adicionou-se em um tubo de ensaio, 1 ml da
solução problema e gotas de ácido acético até o
meio se tornar ácido.
Em seguida, adicionou-se gotas de
K4[Fe(CN)6] 0,2 mol/L e observou-se a formação
de precipitado castanho avermelhado de
ferrocianeto de cobre.](https://image.slidesharecdn.com/aps-150312140343-conversion-gate01/85/Identificacao-dos-cations-Cu2-e-Bi3-18-320.jpg)
![Cu2+ + K4[Fe(CN)6] ⇔ [CuFe(CN)6]](https://image.slidesharecdn.com/aps-150312140343-conversion-gate01/85/Identificacao-dos-cations-Cu2-e-Bi3-19-320.jpg)

![Cu2+ + 2 NH4OH ⇌ [Cu(NH3)4]](https://image.slidesharecdn.com/aps-150312140343-conversion-gate01/85/Identificacao-dos-cations-Cu2-e-Bi3-21-320.jpg)