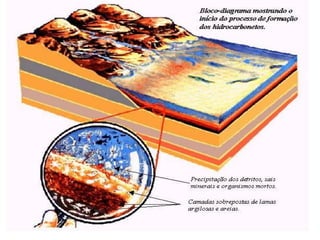
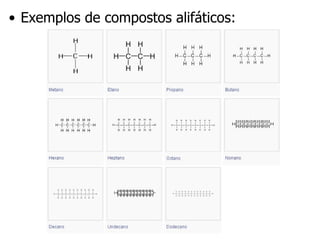
O documento discute hidrocarbonetos, compostos químicos constituídos por carbono e hidrogênio. Apresenta sua classificação em três grupos: cadeia aberta, cadeia fechada e aromáticos. Descreve propriedades como solubilidade e estado físico de acordo com o tamanho molecular, e aplicações como combustíveis devido à capacidade de queima liberando energia.