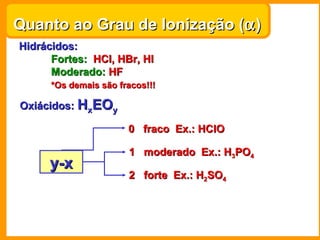
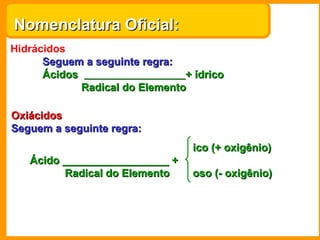
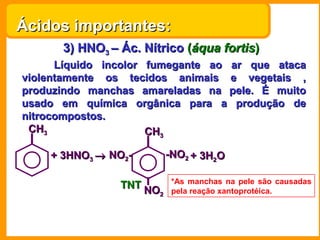
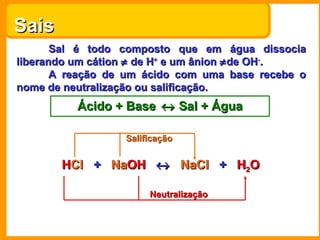
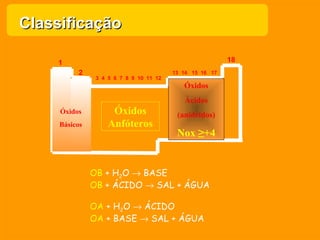
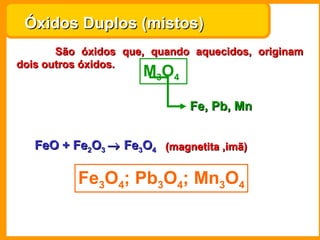
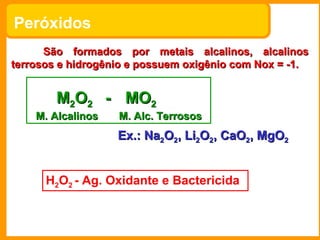
O documento descreve as principais funções químicas inorgânicas, incluindo ácidos, bases, sais e óxidos. Ele fornece exemplos de cada função química e explica suas propriedades e usos, como a produção de ácido sulfúrico, hidróxido de sódio e nitrato de sódio.