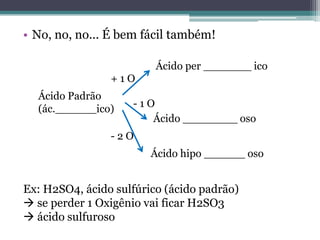
O documento apresenta um resumo da aula de Química sobre funções inorgânicas. Aborda conceitos de ácidos, bases, sais e óxidos, incluindo exemplos e classificações de ácidos como fortes, fracos e voláteis. Explica também a nomenclatura e propriedades dos principais ácidos como sulfúrico, nítrico, clorídrico e fosfórico.