1) O documento descreve a história da tabela periódica, desde as primeiras tentativas de classificação dos elementos químicos até a lei periódica de Moseley.
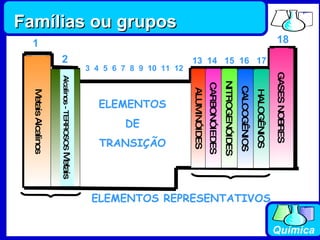
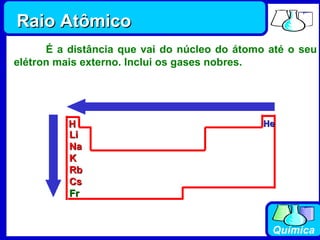
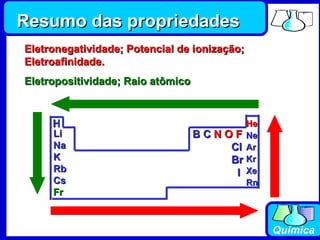
2) A tabela periódica organiza os elementos de acordo com seus números atômicos, formando sete períodos horizontais.
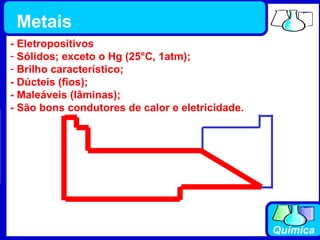
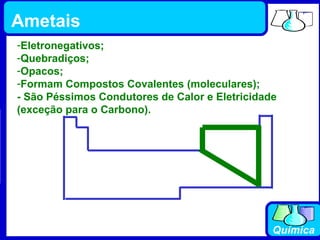
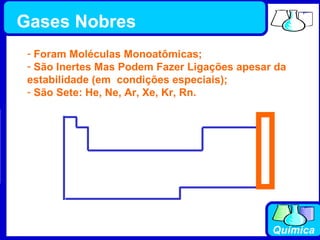
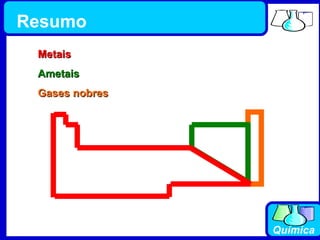
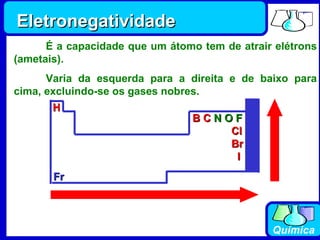
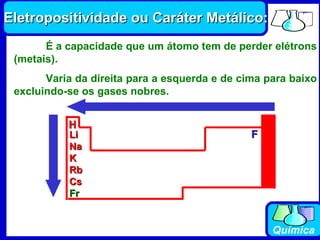
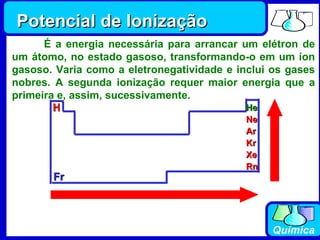
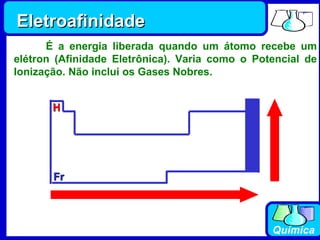
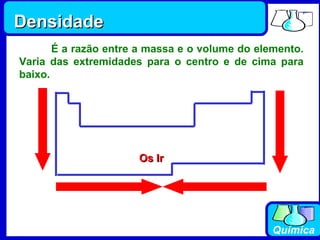
3) Os elementos são representados por símbolos derivados do latim e possuem propriedades químicas características de acordo com sua família ou grupo.