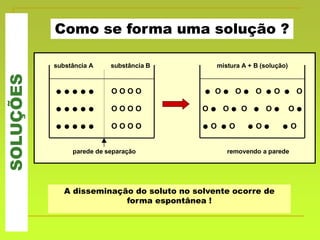
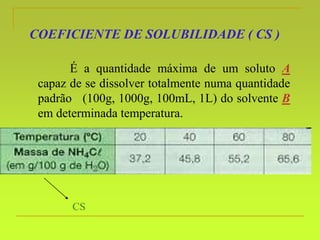
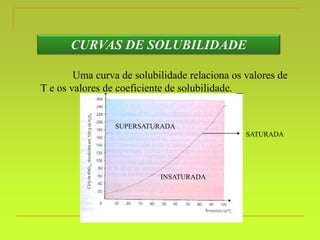
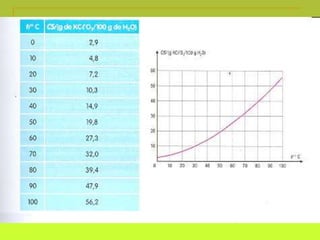
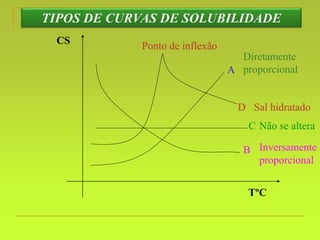
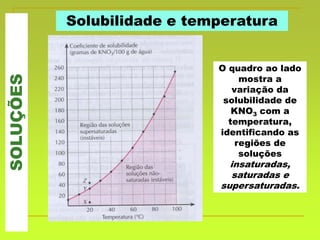
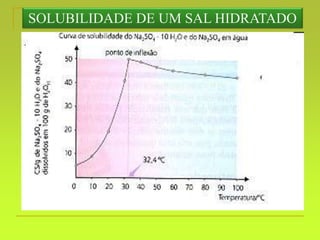
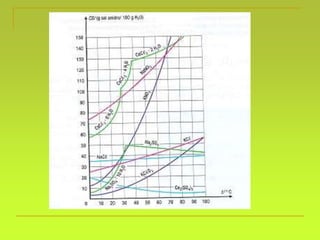
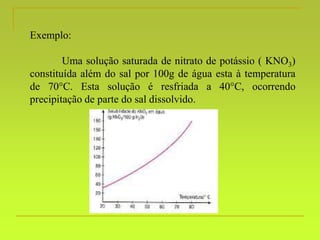
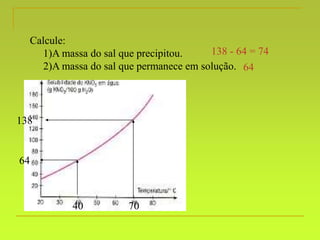
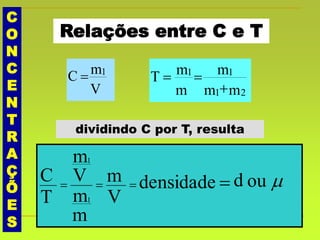
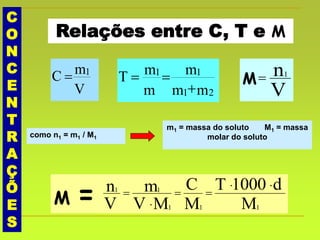
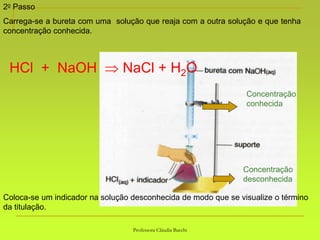
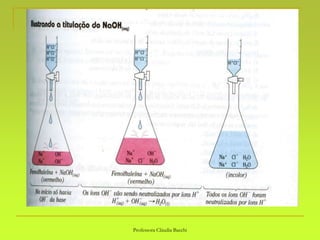
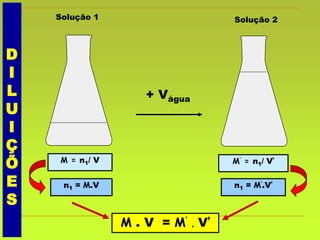
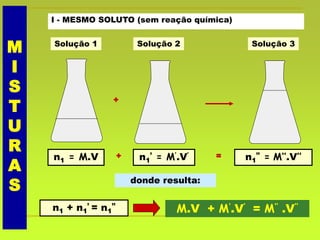
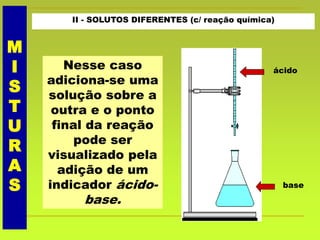
O documento discute soluções, definindo-as como misturas homogêneas de duas ou mais substâncias. Apresenta os tipos de soluções de acordo com o estado físico dos componentes e a natureza das partículas dispersas. Também aborda conceitos como concentração, solubilidade, coeficiente de solubilidade e como esses fatores são afetados pela temperatura.