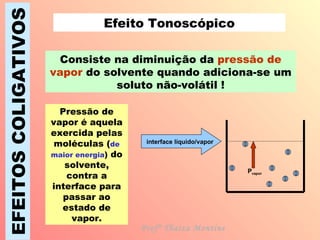
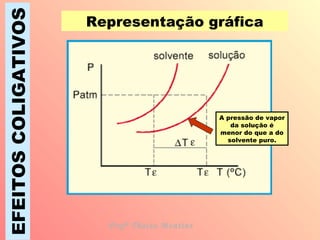
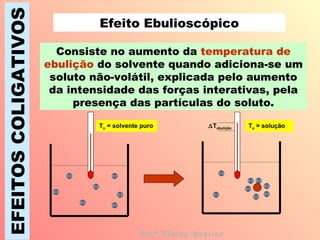
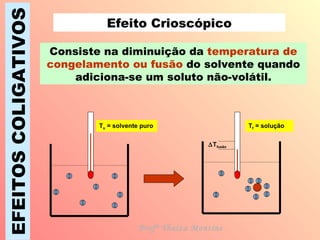
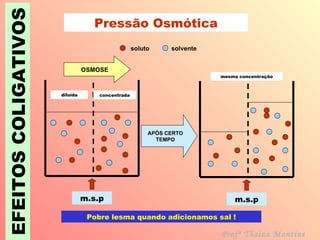
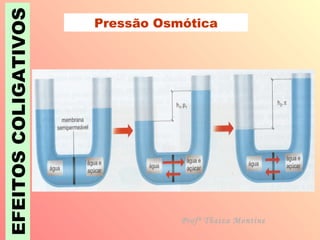
O documento descreve quatro efeitos coligativos de soluções verdadeiras: 1) Efeito tonoscópico causa diminuição da pressão de vapor do solvente; 2) Efeito ebulioscópico causa aumento do ponto de ebulição do solvente; 3) Efeito crioscópico causa diminuição do ponto de fusão do solvente; 4) Efeito osmoscópico causa aumento da pressão osmótica entre soluções separadas por membrana semi-permeável.