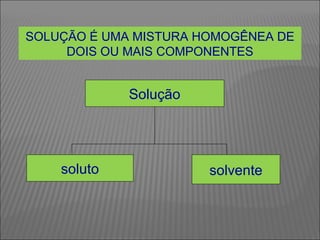
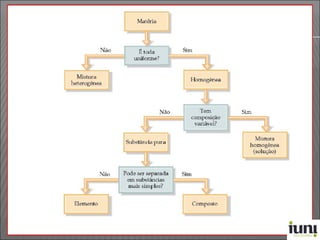
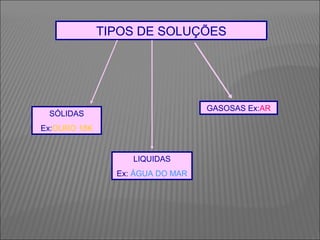
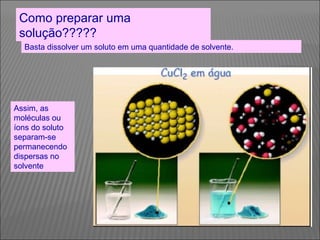
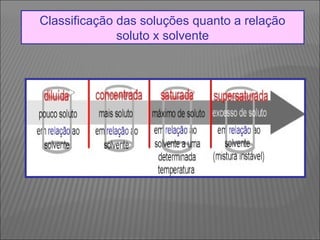
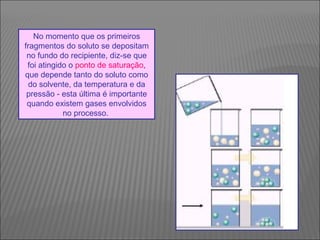
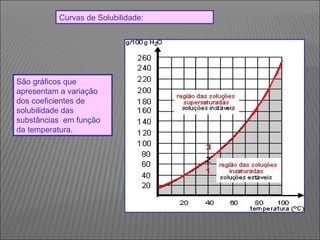
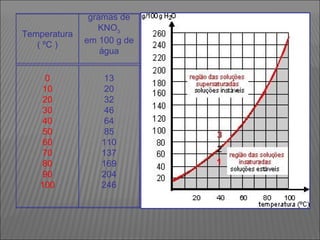
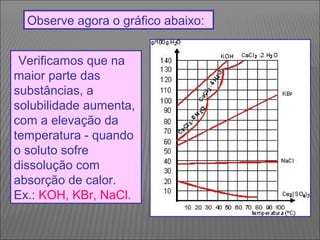
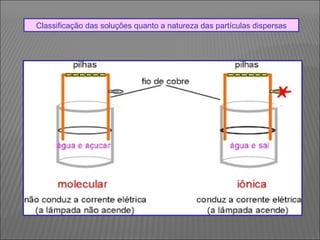
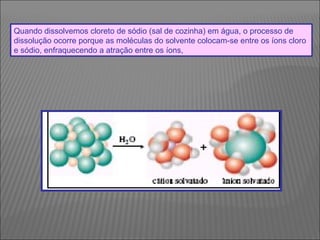
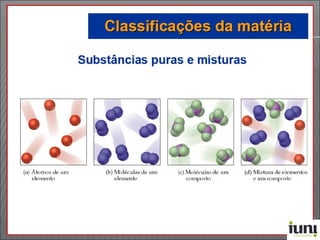
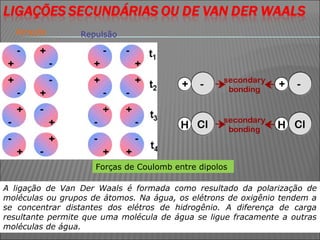
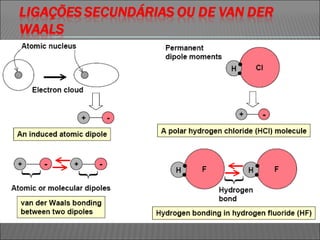
O documento descreve os principais conceitos sobre soluções, incluindo: (1) soluções são misturas homogêneas de dois ou mais componentes; (2) o soluto é o componente em menor quantidade e o solvente é o componente que dissolve o soluto; (3) a solubilidade depende da temperatura e do coeficiente de solubilidade.