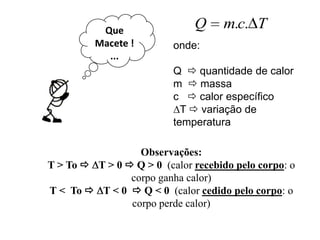
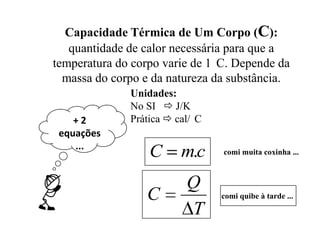
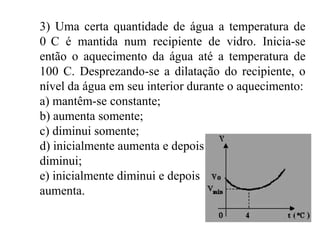
O documento discute conceitos fundamentais de calorimetria, incluindo: (1) calor é energia transferida entre corpos de diferentes temperaturas, (2) existem diferentes tipos de calor como sensível e latente, (3) a equação fundamental da calorimetria relaciona quantidade de calor, massa, calor específico e variação de temperatura.