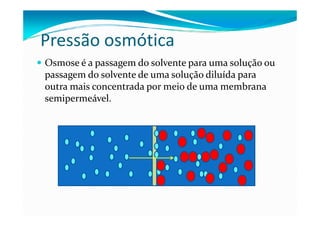
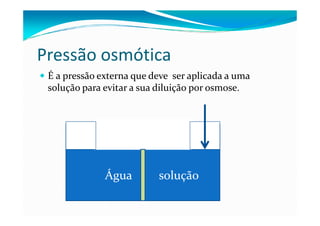
1) As propriedades coligativas dependem do número de partículas na mistura e não da identidade química. São elas: abaixamento da pressão de vapor, aumento do ponto de ebulição, abaixamento do ponto de solidificação e pressão osmótica.
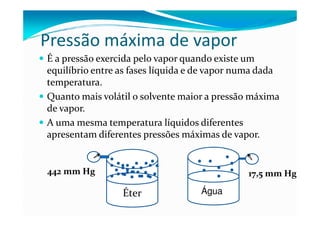
2) A pressão máxima de vapor de um líquido aumenta com a temperatura, facilitando a passagem das moléculas para o estado vapor.
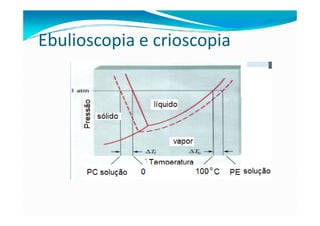
3) Soluções com solutos não voláteis apresentam pontos de ebulição e congelamento diferentes do solvente