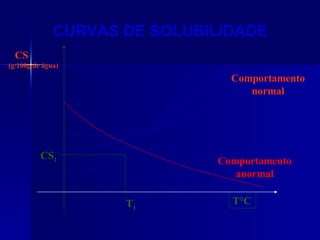
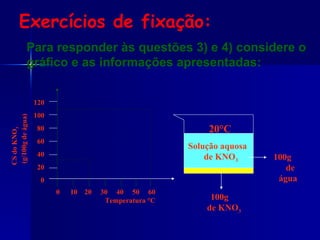
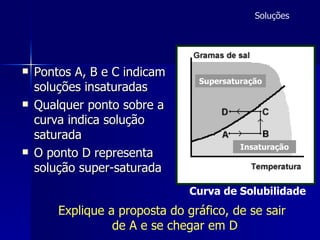
1) O documento discute conceitos de solubilidade e curvas de solubilidade, incluindo coeficiente de solubilidade, soluções saturadas e supersaturadas.
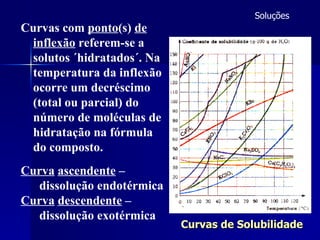
2) É explicado que a concentração de um soluto em uma solução pode variar com a temperatura, conforme mostrado em curvas de solubilidade.
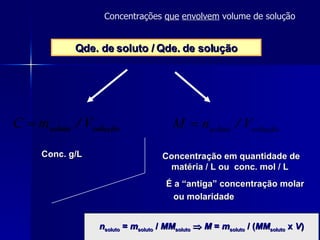
3) A diluição de soluções é abordada, onde a concentração de uma solução original é reduzida pela adição de mais solvente, mantendo a massa total de soluto.
















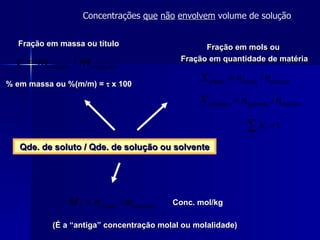
![É importante mencionar que, além da % (m/m) ou % em massa [a massa, em gramas, do soluto em 100 g de solução], outras porcentagens ou frações são possíveis, como: % (m/v): massa, em gramas, de soluto em 100 mL de solução % em mol ou % molar do soluto: X soluto x 100 - raciocínio idêntico se aplica a % em mol do solvente - % em volume ou % (v/v): V soluto /V solução x 100 Concentrações que não envolvem volume de solução](https://image.slidesharecdn.com/solue7f5es-definie7f5es-2209/85/Solu-E7-F5es-Defini-E7-F5es-22-320.jpg)