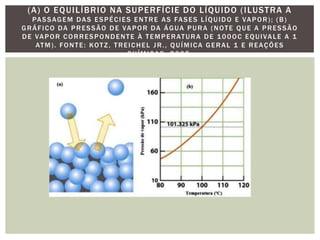
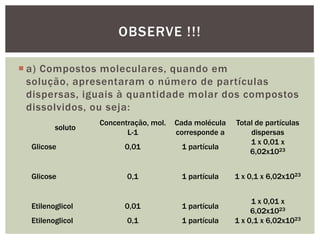
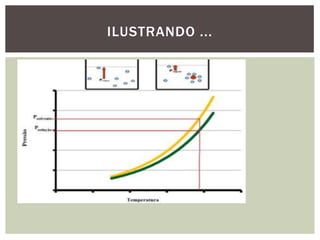
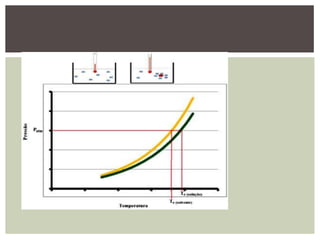
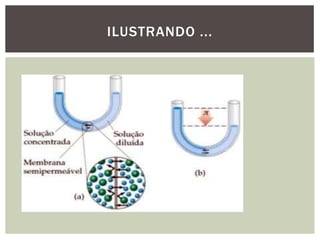
As propriedades coligativas modificam propriedades do solvente quando um soluto não volátil é adicionado. Estas propriedades incluem: 1) diminuição da pressão de vapor e aumento do ponto de ebulição do solvente; 2) diminuição do ponto de fusão do solvente; 3) aumento da pressão osmótica em soluções separadas por uma membrana semipermeável. Estes efeitos dependem do número total de partículas do soluto, não de sua natureza, e são úteis para estudar sistemas biológicos