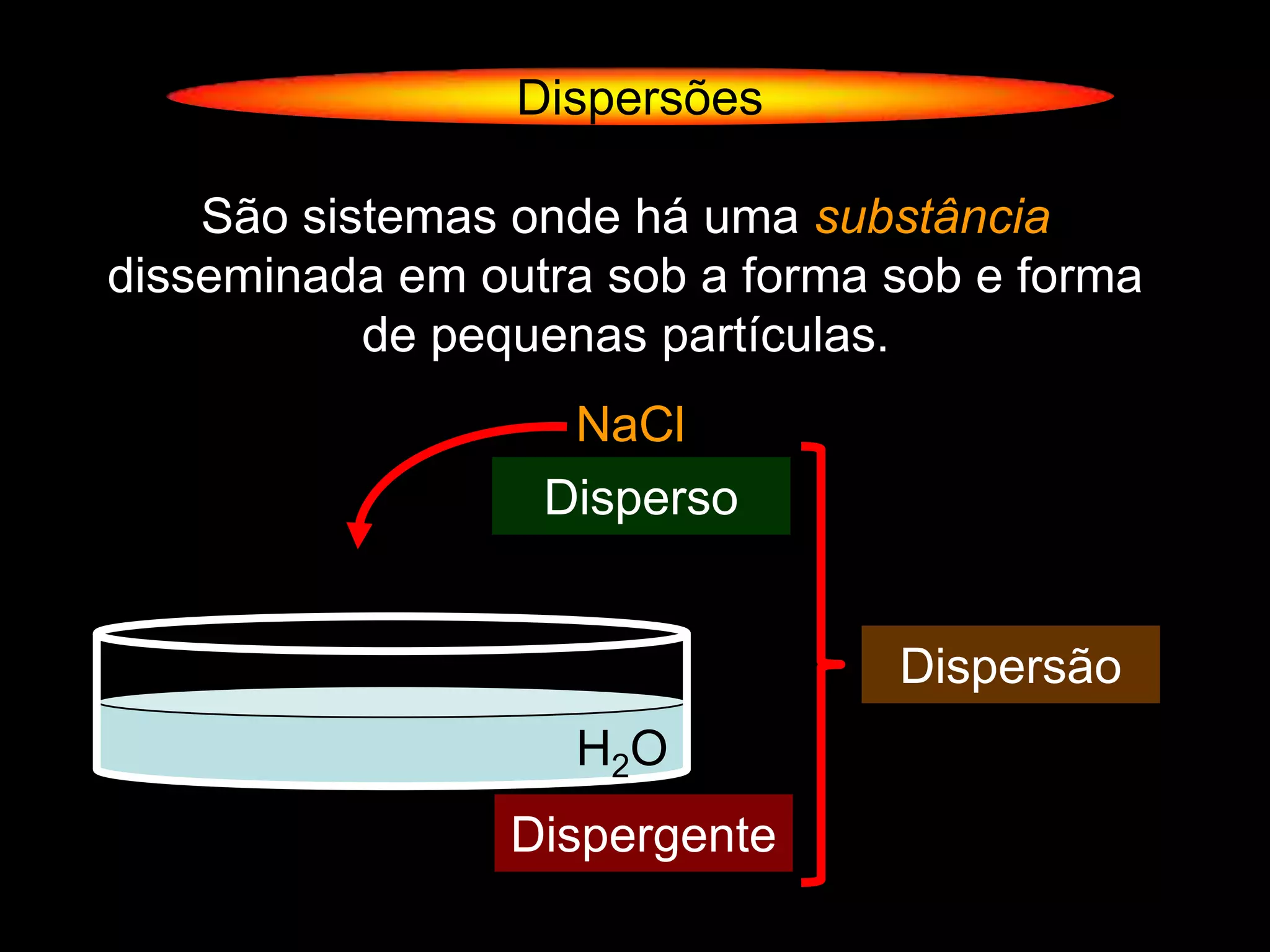
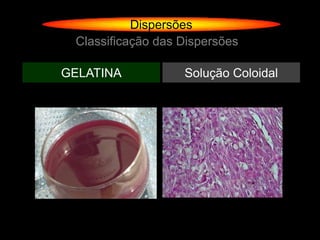
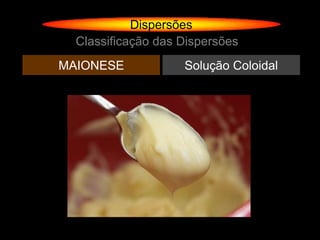
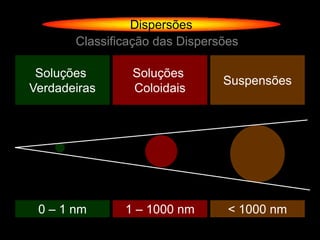
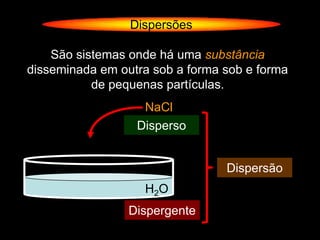
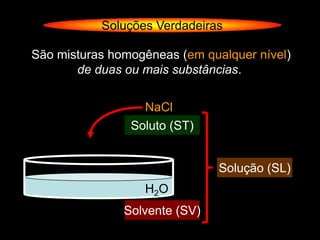
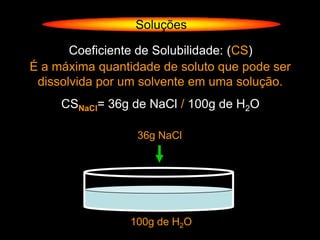
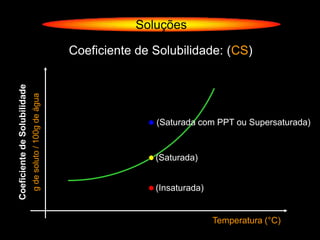
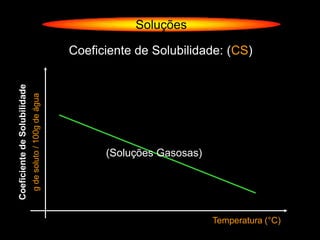
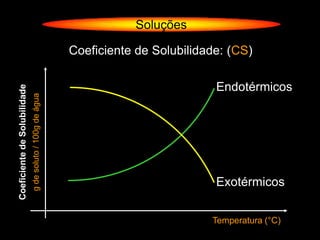
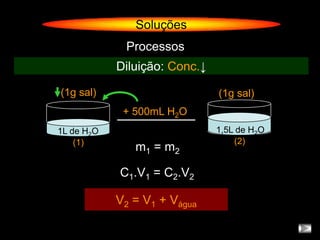
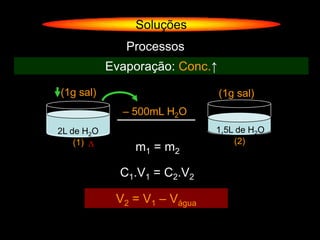
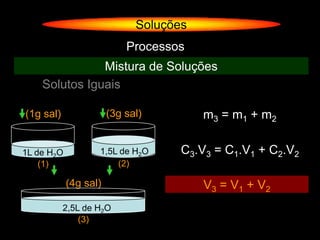
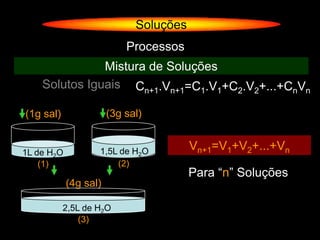
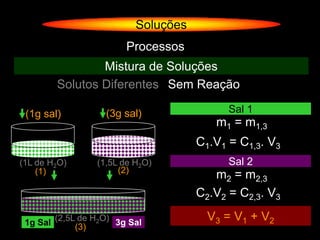
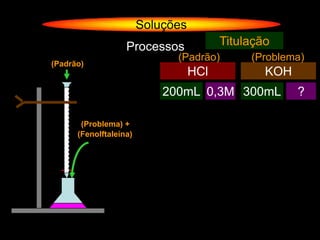
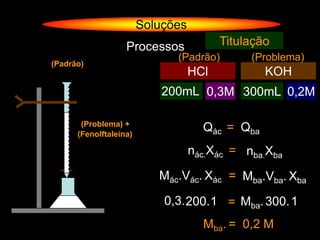
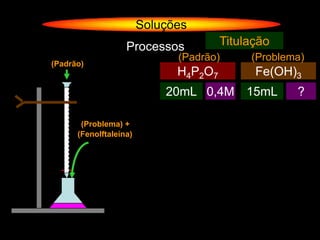
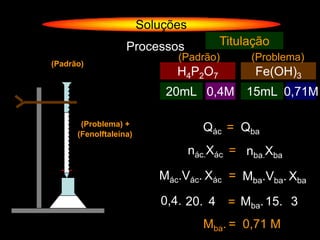
O documento descreve dispersões, que são sistemas onde uma substância é disseminada em outra na forma de pequenas partículas. As dispersões são classificadas em soluções verdadeiras, soluções coloidais e suspensões, dependendo de sua homogeneidade a nível macroscópico e microscópico. O texto também discute conceitos como coeficiente de solubilidade, unidades de concentração e processos que alteram a concentração de soluções, como diluição e evaporação.